Соляная кислота - химическое вещество, что представлено в виде взаимодействия воды и хлористого водорода. В чистом виде кислота не имеет цвета. Технический вид кислоты обладает желтоватым оттенком, потому как содержит железо хлор и некоторые другие элементы. Соляная кислота используется во многих сферах жизнедеятельности человека. Области применения соляной кислоты очень разнообразны. Рассмотрим их дальше.
Применение соляной кислоты в промышленности
К примеру, пищевая промышленность использует кислоту в качестве пищевой добавки Е507. Такая добавка применяется в процессе изготовления водочной продукции, а так же различных сиропов. Применение соляной кислоты в пищевой промышленности, в основном, играет роль регулятора кислотного состояния продуктов. В металлургии пользуется популярностью техническая соляная кислота. Её используют для очистки металла перед паянием или лужением. Травление и декапирование в гальванопластике не обходится без участия соляной кислоты. Она создает активную среду для выше упомянутых процессов.
Чтобы применение соляной кислоты в промышленности не создавало лишних проблем, нужно с ответственностью подходить к выбору её вида и концентрации.
Применение соляной кислоты в быту
Вы, наверное, не задумывались о составе чистящих средств, которыми ежедневно пользуетесь. Во многих из них присутствует соляная кислота. Применение в быту, для унитаза: мы используем средства, которые обладают высокой кислотностью, именно поэтому, стоит их использовать только в резиновых перчатках. Это позволит уберечь ваши руки от раздражения.
Хозяйки используют в домашних условиях раствор соляной кислоты. Применение его в качестве пятновыводителя помогает избавиться от следов ржавчины или чернил на одежде. Соляная кислота должна храниться в стеклянных емкостях в местах, труднодоступных для маленьких детей. Если соляная кислота попала на кожу или слизистые оболочки, необходимо срочно промыть пораженный участок проточной водой. Применение соляной кислоты в домашних условиях должно производиться с соблюдением правил безопасности. Помимо способности к выведению сложных пятен с одежды, соляная кислота применяется для борьбы с накипью. Чтобы не усугубить ситуацию при очистке грязной посуды, рекомендуется применять определенную концентрацию кислоты. В этих случаях используется кислота соляная ингибированная, применение которой позволяет сохранить целостность посуды из хрупких материалов.
Чтобы держать свое жилье и одежду в чистоте, у Вас обязательно должна быть дома соляная кислота. Применение в быту должно быть крайне осторожным, дабы не навредить себе и вещам, с которыми взаимодействуете.
Применение соляной кислоты в медицине
Соляная кислота является одной из составляющих желудочного сока человека. Поэтому, в случае снижения её концентрации, назначают прием лекарственных препаратов на основе соляной кислоты. Применение соляной кислоты в медицине играет особую роль в состоянии здоровья человека с заболеваниями пищеварительного тракта. Благодаря наличию определенного количества соляной кислоты в желудочном соке - пища переваривается, а микроорганизмы, которые попадают в желудок - гибнут.
Для лечения специфических болезней кожи (бородавки) так же используется соляная кислота. Применение в народной медицине нашло широкое распространение: для улучшения пищеварения при пониженой кислотности желудочного сока, перед приемем пищи необходимо принимать препараты соляной кислоты. Применение соляной кислоты (солей) помогает в борьбе с нарушениями пищеварения.
Применение соляной кислоты в строительстве
Для улучшения качестве многих процессов на стройке используется соляная кислота. К примеру, добавление соляной кислоты в бетонную смесь повышает её морозостойкость. Так же, смесь быстрее застывает, а кладка становится более устойчива к влаге. Известно так же применение соляной кислоты в строительстве в качестве очистителя от известняка. Красный кирпич очищается от грязи и следов от строительных материалов с помощью 10% раствора соляной кислоты. Важно помнить, что не все виды кирпичей поддаются воздействию соляной кислоты без повреждения структуры строительного изделия. Поэтому, нужно пользоваться только десятипроцентной соляной кислотой. Химический раствор соляной кислоты значительно экономит финансы, ведь другие очистители могут стоить в десятки раз дороже.
Низкая стоимость не делает применение соляной кислоты менее эффективным. Кислоту используют по многих отраслях промышленности: от медицинской до строительной. Но, как и все остальные кислоты, соляная обладает свойствами раздражать кожу, а высокие концентрации могут привести к ожогам.
Приобрести соляную кислоту вы можете онлайн, перейдя по ссылке
Кислоты
-как химические соединения относительно широко используются в быту. По агрегатному состоянию кислоты могут быть кристаллическими веществами, жидкостями и газообразными. Все кислоты имеют кислый вкус, собственно, именно из-за кислого вкуса они н названы кислотами. Кислоты имеют различные химические свойства: взаимодействую с основаниями, основными оксидами, разрушающе воздействуют на многие металлы, наносят вред организму при попадании на поверхность или вовнутрь. Серная, соляная, уксусная кислоты
могут вызывать сильные ожоги, разрушать ткани. Поэтому при работе с кислотами необходимо соблюдать меры предосторожности. Если кислота попала на одежду или на поверхность тела, то её необходимо очень быстро смыть большим количеством проточной воды или нейтрализовать раствором аммиака (нашатырным спиртом). А если кислота попала на деревянную, металлическую или на другие поверхности, то ее нейтрализуют известью, мелом или содой. Кислоты необходимо хранить в хорошо укупоренной посуде в недоступном месте для детей, и обязательно на таре должна быть бирка с названием кислоты. Где же, для каких целе применяются кислоты в быту?
Соляная кислота
хорошо растворяет металлы, в том числе цинк, олово, железо, но не взаимодействуес с золотом, серебром и медью. Соляную кислоту можно смешивать с водой в любых соотношениях. Применяется для очистки от известкового налета раковины эмалированные и фаянсовые, унитазы, умывальники. Можно применять для очистки тканей от ржавых пятен, чернил (готовится слабый раствор кислоты). Соляная кислота разрушает ткани, изготовленные льна, хлопка, искусственного шелка. При попадании на кожу вызывает химические ожоги
Серная кислота является более сильной кислотой чем соляная, концентрированная обугливает сахар, дерево, хлопок, шерсть и вызывает очень глубокие ожоги кожи. При приготовлении раствора серной кислоты необходимо следовать следующему правилу: Кислоту льют в воду тонкой струйкой по стенке стеклянной посуды, но не наоборот. Серную кислоту, за счет ее свойства поглощать большие количества воды, использую для осущения в зимнее время окон, предворительно поставив между рамами концентрированную серную кислоту в стакане, заполненив на 1/5 объема.Серная кислота также применяется для приготовления аккумуляторной кислоты.
Азотная кислота
в быту используется только в виде разбавленных растворов для чистки изделий, в первую очередь из благородных металлов.
Уксусная кислота
применяется либо в виде столового уксуса, с концентрацией кислоты до 9% или в виде 80 процентной эссенции.
Разбавленная кислота не действует на металлы, ткани растительного и животного происхождения, покровы человека и животных. Уксус применяется в качестве приправы к блюдам для уменьшения жесткости воды, удаления фруктовых пятен с тканей.
Щавелевая кислота
применяется для удаления пятен от чернил, краски, ржавчины. Кристаллическая кислота может вызвать ожоги слизистых оболочек ротовой полости, пищевода и желудка. Является ядовитым веществом.
Муравьиная кислота похожа на уксусную, но ядовита, вызывает очень сильные ожоги и раздражение кожи.
Лимонная кислота -кристаллическое бесцветное вещество, хорошо растворимое в воде и этиловом спирте. Используется для выведения всевозможных пятен: от вина, различных ягод, красок, ржавчины, чернил.
Борная кислота - кристаллическое вещество бесцветное, в медицине (борная мазь), в качестве микроудобрения и средства для борьбы с тараканами и домовыми муравьями.
Различают два вида кислот: органические и неорганические, различия между ними в том, что первые всегда содержат молекулы углерода.
Органические кислоты поступают в организм с ягодами, овощами, фруктами и молочными продуктами. Некоторые кислоты являются витаминами, как, например, витамин С – аскорбиновая кислота.
Неорганические кислоты тоже могут поступать с продуктами питания, но могут и вырабатываться организмом самостоятельно. Соляная кислота присутствует в желудочном соке, под ее действием погибают бактерии, попадающие в желудок с пищей. Сероводородная кислота содержится в минеральной воде.
Применение кислот
Серная кислота занимает первое место среди кислот. Она в больших количествах применяется для производства удобрений, химических волокон, пластмасс, лекарств. Ею заполняют кислотные аккумуляторы, используют для извлечения металлов из руды. В нефтяной промышленности ее применяют для очистки нефтепродуктов.
Уксусная кислота обладает бактерицидным действием, ее раствор применяют при консервировании продуктов питания, для получения лекарств, при производстве ацетона, в крашении и книгопечатании.
Соляная кислота используется для обработки зон скважин в нефтяной промышленности.
Азотная кислота играет большую роль при производстве удобрений, лаков, красителей, пластмасс, взрывчатых и лекарственных веществ.
Фосфорная кислота входит в состав обезжиривающих составов для металлических материалов перед нанесением на них защитных составов. Включается в состав веществ для преобразования ржавчины перед нанесением краски, и применяется в качестве защиты от коррозии трубопроводов.
Лимонная кислота применяется при создании косметических средств, в качестве разбавителя и консерванта. Благодаря своим свойствам отбеливать, очищать и вяжущему действию, она входит в состав очищающих кремов, ополаскивателей для волос, кремов от пигментации, красок для волос.
Ацетилсалициловая кислота эффективна при профилактике заболеваний сердечно-сосудистой системы, уменьшает образование тромбов, обладает анальгезирующим эффектом, поэтому усиленно применяется в медицине.
Борная кислота также применяется в медицине из-за своего антисептического свойства. Ее применяют при педикулезе (вшивости), при лечении отитов, конъюнктивитов, воспалений кожных покровов.
Стеариновая кислота используется в мыловарении. Добавление ее в мыло гарантирует, что продукт будет делать кожу гладкой, мягкой и обладать успокаивающим эффектом.
КУРСОВАЯ РАБОТА
СОЛЯНАЯ КИСЛОТА. ТОВАРОВЕДЕНИЕ
Введение
1. Применение СОЛЯНОЙ КИСЛОТЫ в сфере производства или потребления
3. Технология производства СОЛЯНОЙ КИСЛОТЫ и ее технико-экономическая оценка
4. Стандарты на СОЛЯНУЮ КИСЛОТУ, нормируемые показатели качества в соответствии с требованиями стандартов
5. Контроль качества товара. Стандарты на правила приемки, испытания, хранения и эксплуатации товара
5.2.1 Маркировка
5.2.2 Упаковка
5.2.3 Требования безопасности
5.2.4 Приемка
5.2.5 Методы анализа
Заключение
Список ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
Введение
Объем производства продукции на предприятиях химической и нефтехимической промышленности Беларуси в январе-июле текущего года увеличился в сопоставимых ценах на 5,4% по сравнению с соответствующим периодом прошлого года и составил около Br3,7 трлн.
Для успешной работы на этом поприще необходимым является постоянный контроль качества продукции, а также улучшение ее качественных характеристик.
Соляная кислота является важнейшим продуктом химической промышленности и представляет собой бесцветную жидкость с острым запахом хлористого водорода.
Целью курсовой работы является анализ потребительских свойств и областей применения соляной кислоты.
В ходе работы следует выполнить ряд задач
Рассмотреть применение соляной кислоты в области производства и потребления;
Определить классификационные признаки соляной кислоты;
Проанализировать технологию производства соляной кислоты;
Рассмотреть показатели качества;
Выявить стандарты на правила приемки, испытания, хранения соляной кислоты.
Объектом курсовой работы является кислота соляная.
В ходе работы были использованы учебные пособия по товароведению непродовольственных товаров таких авторов как Епифанцевой В.В., Сыцко В.Е., Карольковой Р.В. и других авторов, а также учебные пособия по химической промышленности, а также средства массовой информации.
Курсовая работа состоит из пяти глав, заключения-вывода, а так же списка используемых источников.
1. Применение СОЛЯНОЙ КИСЛОТЫ в сфере производства или потребления
Отгрузка производится железнодорожными цистернами, в полиэтиленовых бочках емкостью 20-45 3, в полиэтиленовых канистрах емкостью 20, 40 и 50 дм3.
Кстати, известный факт, что соляная кислота содержится в желудочном соке (около 0,3 %) и играет важную роль, так как способствует перевариванию пищи и убивает различные болезнетворные бактерии (холеры, тифа и др.). Если последние попадают в желудок вместе с большим количеством воды, то вследствие разбавления раствора НСl они выживают и вызывают заболевание организма. Поэтому во время эпидемий особенно опасна сырая вода. При повышении концентрации НСl в желудке ощущается «изжога», которую устраняют, принимая внутрь небольшое количество NаНСО 3 или МgО. Наоборот, при недостаточной кислотности желудочного сока соляная кислота прописывается для приема внутрь (по 5-15 капель 8,3 %-ной НСl на 1/2 стакана воды до или во время еды).
Производство кислоты соляной синтетической освоено в 1962 году. За период эксплуатации производился ремонт, усовершенствовалось технологическое оборудование. Высокое качество сырья позволяет получать кислоту высокого качества. Кислота соляная также применяется в производстве пластмасс, ядохимикатов, полупродуктов и красителей для очистки поверхности металлов от окислов, карбонатов, в электротехнической, текстильной промышленности.
Кислота соляная ингибированная Марка А – применяется для кислотной обработки скважин в нефтяной промышленности с целью улучшения сообщаемоести скважин с пластом (для расширения и очистки пор и трещин, снятия фильтрационного сопротивления коллектора, сложенного карбонатными породами-доломитами и известняками, или загрязненного карбонатными отложениями).
Кислота соляная марки Б – применяется для травления черных и некоторых цветных металлов и изделий из них, для химической очистки котлов и аппаратов от неорганических отложений.
Соляную кислоту применяют для получения хлоридов Zn, Ba. Mg, Са, Fe, A1 и т. д., для травления при пайке и лужении, и цветной металлургии (извлечение Pt, An), при гидролизе древесины, в производстве красителей, для гидрохлорировании органических соединении и т. д.
2. Классификационные признаки СОЛЯНОЙ КИСЛОТЫ
Соляную кислоту изготовляют двух марок: А и Б.
По физико-химическим показателям техническая синтетическая соляная кислота должна соответствовать нормам, указанным в таблице 2. 1.
Таблиц 2.1 Нормы для соляной кислоты.
| Наименование государства | Норма для марки | Методы анализа | ||
| АОКП 21 2211 0100 | БОКП21 2211 0200 | |||
| 1. Внешний вид | Прозрачная желтая жидкость | По 6.4 | ||
| 35 | 33 | 31,5 | По 6.5 | |
| 0,001 | 0,002 | 0,015 | По 6.6 | |
| 0,010 | 0,015 | 0,100 | По 6.7 | |
| 0,002 | 0,002 | 0,008 | По 6.8 | |
| 0,0001 | 0,0001 | 0,0002 | По 6.9 | |
| 0,0003 | 0,0004 | 0,0005 | По 6.10 | |
Массовую долю ртути нормируют в кислоте, получаемой из водорода и хлора ртутного электролиза. Допускается для пищевой промышленности по согласованию с потребителем изготовление кислоты с массовой долей хлористого водорода не более 26%.
В кислоте, поставляемой для травления металлов, массовая доля железа и остатка после прокаливания не нормируется.
По согласованию с потребителем допускается в кислоте обеих марок массовая доля хлористого водорода не менее 30%.
Соляная кислота выпускается следующих сортов: техническая (27,5% НС1); синтетическая (31% НС1), ингибиторная (20% НС1) и реактивная (35-38% НС1, плотность при 20°С равняется 1,17- 1,19 г/см3).
3. Технология производства СОЛЯНОЙ КИСЛОТЫ и ее технико-экономическая оценка
Сульфатным;
Синтетическим,
Однако следует отметить, что первые два метода теряют свое промышленное значение.
Производство соляной кислоты (реактивной, полученной сульфатным способом, синтетической абгазной) заключается в получении HCI с последующей его абсорбции водой. В зависимости от способа отвода теплоты абсорбции, которая достигает 72,8 кДж/моль процессы разделяются на изотермические (при постоянной температуре), адиабатические (без теплообмена с окружающей средой) и комбинированные.
1. Сульфатные метод основан на взаимодействии хлорида натрия NaCl с концентрированной серной кислотой H2SO4 при 500-550*С. Реакционные газы отходящие от муфельных печей содержат 50-65% хлороводорода, а газы от реакторов с кипящим слоем до 5% HCI. В настоящее время предложено заменить серную кислоту на смесь SO2 и О2 с использованием в качестве катализатора Fe2O3 и проведением процесса при температуре 540*.
2. В основе прямого синтеза соляной кислоты лежит цепная реакция горения:
Р2-CI2+2HCI +184,7кДж (3.1)
Реакция инициируется светом, влагой, твердыми пористыми веществами (древесный уголь, пористая платина) и некоторыми минеральными веществами (кварц, глина). Синтез в камерах сжигания ведут с избытком в 5-10% Н2. Камеры выполнены из стали, графита, кварца, огнеупорного кирпича. Наиболее современным материалом, предотвращающий загрязнение продукта является графит, импрегнированный фенолоформальдегидными смолами. Для предотвращения взрывного характера горения реагенты смешивают непосредственно в факеле пламени горелки. В верхней зоне камер сжигания устанавливают теплообменники для охлаждения реакционных газов до 150-160*С. Мощность современных графитовых печей достигает 65т/сут (в пересчете на соляную кислоту содержащую 35% HCI). В случае дефицита водорода применяют различные модификации процесса. Например, пропускают смесь CI2 c водяным паром через слой пористого раскаленного угля:
CO+H2O+CI2=2HCI+CO2 (3.2)
Более 90% соляной кислоты в СНГ в настоящее время получают их абгазного хлороводорода HCI, образующегося при хлорировании и дегидрохлорировании органических соединений, пиролизе хлорорганических отходов, хлоридов металлов, получении калийных нехлорированных удобрений и др.
Абгазные газы содержат различные количества хлороводорода, инертные примеси (N2H2CH4), малорастворимые в воде органические вещества (хлорбензол, хлорметаны), водорастворимые вещества (уксусная кислота, хлораль), кислые примеси и воду.
HCI в абгазных газах. Наиболее перспективными являются абсорберы, позволяющие извлекать из исходного абгаза от 65-85% HCI.
В промышленности для получения соляной кислоты наиболее широко применяют схемы адиабатической абсорбции. Абгазные газы вводят в нижнюю часть абсорбера, а воду (или разбавленную соляную кислоту – противотоком в верхнюю.
Соляная кислота нагревается до температуры кипения благодаря температуре растворения HCI. Зависимость изменения температуры абсорбции и концентрации HCI показана на рис. 3.1
Рис . 3.1 Схема распределения температур (кривая 1) и концентрации (кривая 2) HCI при высоте адиаботического абсорбера
Температура абсорбции определяется температурой кипения кислоты соответствующей концентрации, максимальная температура кипения азеотропной смеси находится около 110*.
Типовая схема адиабатической абсорбции HCI из абгазов, образующихся при хлорировании, представлена на рисунке 4.2. Хлороводород поглощается в абсорбере 1, а остатки малорастворимых в воде органических веществ отделяют от воды после конденсации в аппарате 2, дочищают в хвостовой колонне 4 и сепараторах 3,5 и получают товарную соляную кислоту.
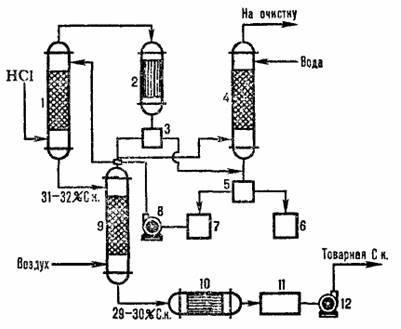
1 – абиабатический абсорбер; 2 – конденсатор; 3, 5 – сепараторы; 4 – хвостовая колонна; 6 – сборник органической фазы; сборник водной фазы; 8,12 – насосы; 9 – отдувочная колонна; 10- теплообменник, 11 – сборник товарной кислоты.
Рис.3.2 Схема типовой адиабатический абсорбции соляной кислоты из абгазов
Получение соляной кислоты из абгазных газов с использованием комбинированной схемы абсорбции представлено в виде типовой схемы на рис.3.3.
В колонне адиабатической абсорбции получают соляную кислоту пониженной концентрации, но свободную от органических примесей. Кислоту с повышенной концентрацией HCI производят в колонне изотермической абсорбции при пониженной температуре. Степень извлечения HCI из абгазов при использовании в качестве абсорбентов разбавленных кислот составляет 90-95%. При использовании в качестве абсорбента чистой воды степень извлечения почти полная.
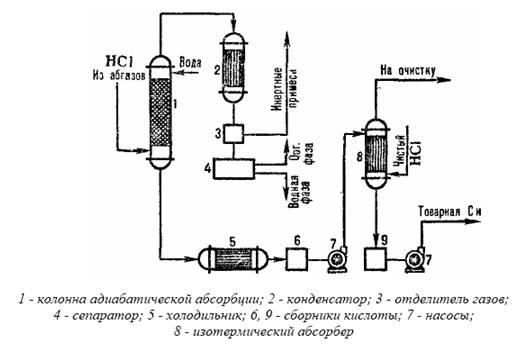
Рис.3.3 Схема типовой комбинированной абсорбции соляной кислоты из абгазных газов
Хлористый водород используют для производства хлорорганических продуктов путем гидрохлорировании органических соединений, например этилена, ацетилена.
4. Стандарты на СОЛЯНУЮ КИСЛОТУ, нормируемые показатели качества в соответствии с требованиями стандартов
Гост – это государственный стандарт качества.
Кислота соляная должна соответствовать следующим ГОСТам:
ГОСТ. 14261-77 . Кислота соляная особой чистоты. Технические условия. Дата введения 01-07-1978. Дата изменения – 01.12.1987.
Стандарт распространяется на соляную кислоту особой чистоты, которая представляет собой бесцветную прозрачную жидкость, дымящуюся на воздухе.
ГОСТ 30553-98. Кислота соляная техническая. Определение общей кислотности титриметрическим методом. Код МКС 71.060.30 Дата введения 01.01.2001. Устанавливает титриметрический метод определения общей кислотности (содержание хлористого водорода) в технической соляной кислоте.
ГОСТ 30554-98 Кислота соляная техническая. Определение сульфатной золы весовым методом. Дата введения 01-07-2003.
ГОСТ 30582-98. Кислота соляная техническая. Определение содержания железа спектрометрическим методом с применением 2,2"-бипиридила. Дата введения 01-07-2003.
ГОСТ 30621-98. Кислота соляная техническая. Определение содержания мышьяка фотометрическим методом с применением диэтилдитиокарбамата серебра. Дата введения 01-07-2003.
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия. Стандарт распространяется на соляную кислоту (водный раствор хлористого водорода), представляющую собой бесцветную жидкость с резким запахом, дымящую на воздухе; смешивается с водой, бензолом и с эфиром.
ГОСТ 857-95. Кислота соляная синтетическая техническая. Технические условия. Стандарт распространяется на техническую синтетическую соляную кислоту, получаемую абсорбцией водой хлористого водорода, образующегося при взаимодействии испаренного, электролитического хлора, абгазов сжижения хлора с водородом.
5. Контроль качества товара. Стандарты на правила приемки, испытания, хранения и эксплуатации товара
5.1 Теоретические основы качества и стандартизации продукции
СТАНДАРТ (от англ. standard - норма, образец), в широком смысле слова - образец, эталон, модель, принимаемые за исходные для сопоставления с ними др. подобных объектов. Стандарт как нормативно-технический документ устанавливает комплекс норм, правил, требований к объекту стандартизации. Стандарт может быть разработан как на материальные предметы (продукцию, эталоны, образцы веществ), так и на нормы, правила, требования в различных областях.
ТЕХНИЧЕСКИЕ УСЛОВИЯ (ТУ) - это нормативно-технический документ, устанавливающий комплекс требований к продукции конкретных типов, марок, артикулов. Разрабатываются на основе соответствующих стандартов.
ТЕХНОЛОГИЧЕСКАЯ КАРТА - это форма технологической документации, в которой записан весь процесс обработки изделия, указаны операции и их составные части, материалы, производственное оборудование и технологические режимы, необходимое для изготовления изделия время, квалификация работников и т. п.
МАРШРУТНЫЙ ЛИСТ (карта) – это документ по учету выработки продукции и движения партии обрабатываемых деталей по операциям.
ТЕХНИЧЕСКИЙ РЕГЛАМЕНТ - документ, содержащий обязательные для соблюдения требования общества, утвержденный компетентным правительственным органом. Для лесоматериалов к техническим регламентам относятся документы, содержащие требования по радиационной и фитосанитарной безопасности, а также безопасности транспортирования и обработки.
Качество товара (работы, услуги) - совокупность характеристик товара (работы, услуги), относящихся к его способности удовлетворить установленные и (или) предполагаемые потребности потребителя (безопасность, функциональная пригодность, эксплуатационные характеристики, надежность, экономические, информационные и эстетические требования и др.
Комплекс реализуемых мер в области качества включает освоение и выпуск новой продукции, внедрение ресурсосберегающих технологий, а также реконструкцию и техническое перевооружение производств.
Сертификат качества - письменный документ или клеймо признанного аффинажера, которое свидетельствует о названии драгоценного металла, его пробе, серийном номере и о названии компании производителя
Технический кодекс устанавливает правила разработки, включая утверждение, государственную регистрацию технических регламентов, а также правила их проверки, пересмотра, изменения, отмены, применения, официального издания, уведомления о ходе разработки и опубликования информации о технических регламентах.
Государственный стандарт - одна из основных категорий стандартов в РБ.
Интеграция Республики Беларусь в мировую экономику, активизация внешнеэкономической деятельности, продвижение белорусской продукции на международные рынки, а также задачи социально-экономического развития страны обусловили необходимость реформирования технического законодательства.
В 2004 году был принят и вступил в действие Закон Республики Беларусь "О техническом нормировании и стандартизации" который основан на положениях Соглашений Всемирной торговой организации, учитывает аспекты систем технического регулирования и стандартизации России, Украины и других стран, а также Европейского Союза.
5.2 Контроль качества соляной кислоты. Технические требования
Соляную кислоту изготовляют двух марок: А и Б. По физико-химическим показателям техническая синтетическая соляная кислота должна соответствовать нормам, указанным в таблице 5.1.
Таблица 5.1 Нормы соляной кислоты
| Наименование государства | Норма для марки | Методы анализа | ||
| АОКП 21 2211 0100 | БОКП21 2211 0200 | |||
| высшего сорта ОКП 21 2211 0220 | первого сорта ОКП 21 2211 0230 | |||
| 1. Внешний вид | Прозрачная бесцветная или желтоватая жидкость | Прозрачная желтая жидкость | По 6.4 | |
| 2. Массовая доля хлористого водорода, %,не менее | 35 | 33 | 31,5 | По 6.5 |
| 3. Массовая доля железа (Fe), %, не более | 0,001 | 0,002 | 0,015 | По 6.6 |
| 4. Массовая доля остатка после прокаливания, %, не более | 0,010 | 0,015 | 0,100 | По 6.7 |
| 5. Массовая доля свободного хлора, %, не более | 0,002 | 0,002 | 0,008 | По 6.8 |
| 6. Массовая доля мышьяка (As), %, не более | 0,0001 | 0,0001 | 0,0002 | По 6.9 |
| 7. Массовая доля ртути (Hg), % не более | 0,0003 | 0,0004 | 0,0005 | По 6.10 |
Внешний вид определяют визуально в проходящем свете столба жидкости, налитой в цилиндр 1,2-100 по ГОСТ 1770.
Метод определения основан на реакции нейтрализации ионов водорода гидроокисью натрия:
(5.1)
В качестве индикатора применяют метиловый оранжевый.
Аппаратура, реактивы, растворы:
Бюретка 1, 25 3-25-0,1 по ГОСТ 29251;
Колба Кн- 1,2- 100, 250-1 по ГОСТ 25336;
Колба 2-250, 1000 по ГОСТ 1770;
Пипетка 2-20 по ГОСТ 29169;
Цилиндр 1,2-25 по ГОСТ 1770;
Натрия гидроокись по ГОСТ 4328, х.ч., раствор концентрации c(NaON) = 0,1 моль/дм 3 , готовят по ГОСТ 25794.1;
Метиловый оранжевый (индикатор), раствор с массовой долей 0,1%; водный раствор готовят по ГОСТ 4919,1;
Вода дистиллированная по ГОСТ 6709 и не содержащая углекислоты, готовят по ГОСТ 4517.
В предварительно взвешенную колбу с притертой пробкой вместимостью 100 см 3 и содержащую 20 см 3 воды помещают 3 см 3 анализируемой кислоты и снова взвешивают (результат взвешивания записывают с точностью до четвертого десятичного знака). Раствор количественно переносят в мерную колбу вместимостью 250 см 3 , многократно ополаскивают дистиллированной водой, сливая в мерную колбу, доводят объем водой до метки и перемешивают. Пипеткой отбирают 20 см 3 полученного раствора соляной кислоты в коническую колбу вместимостью 250 см 3 , добавляют 25 см 3 воды, 2-3 капли метилового оранжевого индикатора и титруют раствором гидроокиси натрия до перехода красной окраски в желтую.
Массовую долю хлористого водорода X , %, вычисляют по формуле:
где V - объем раствора гидроокиси натрия концентрации точно с (NaOH) = 0,1 моль/дм 3 , пошедший на титрование, см 3 ;
V 1 - объем раствора анализируемой соляной кислоты, взятый для выполнения анализа, см 3 ;
m - масса колбы с водой, г;
m 1
- масса колбы с водой и анализируемой кислотой, г;
0,003646 - масса хлористого водорода, соответствующая 1 см 3
раствора гидроокиси натрия, концентрации точно с (NaOH) = 0,1 моль/дм 3
, г/см 3
.
За результат анализа принимают среднеарифметическое результатов двух параллельных измерений, допускаемые расхождения между которыми не должны превышать 0,3 % при доверительной вероятности Р = 0,95 .
Допускаемые расхождения между результатами, полученными в двух лабораториях, не должны превышать 0,6 %. Относительная суммарная погрешность определения ±2 % при доверительной вероятности Р= 0,95 .
Массовую долю железа определяют в соляной кислоте после разбавления пробы без ее предварительной нейтрализации. Нейтрализацию проводят после введения сульфосалицшювой кислоты, то есть одновременно проходят нейтрализация и образование сульфосалицилатного комплекса железа 3, окрашенного в слабощелочной среде (рН8,0- 11,5) в желтый цвет. Интенсивность светопоглощения образовавшегося комплекса измеряют на фотоэлектроколориметре. Диапазон измерения 5·10 -4 - 2,0·10 -2 %.
Аппаратура, растворы, реактивы:
Колориметр фотоэлектрический лабораторный ФЭК-56М, КФК или другого типа, обеспечивающий заданную чувствительность и точность;
Секундомер механической любой марки;
Стаканчик СЗ-14/8 по ГОСТ 25336;
Колбы 1,2-50, 100, 250 и 1000 см 3 по ГОСТ 1770;
Пипетки 1, 2, 5, 7-1, 25, 2, 5, 10 по ГОСТ 29169;
Кислота соляная по ГОСТ 3118, х.ч., водный раствор (1:1);
Аммиак водный по ГОСТ 3760, ч.д.а., раствор с массовой долей 25 %;
Кислота сульфосалициловая по ГОСТ 4478, ч.д.а., раствор концентрации 100 г/дм 3 ;
Квасцы железоаммонийные согласно действующей нормативной документации;
Раствор железа концентрации 1 мг/см 3 готовят по ГОСТ 4212, разбавлением готовят раствор концентрации 10 мкг/см 3 , свежеприготовленный;
Вода дистиллированная по ГОСТ 6709.
Подготовка к анализу
Приготовление раствора сульфосалицшювой кислоты 10 г сульфосалицшювой кислоты переносят в мерную колбу вместимостью 100 см 3 , растворяют, доводят объем водой до метки, перемешивают. Результаты взвешивания записывают с точностью до второго десятичного знака.
Приготовление градуировочных растворов и градуировка фотоэлектроколориметра.
Градуировку и определение проводят по ГОСТ 10555 сульфосалициловым методом.
В мерные колбы вместимостью 50 см 3 вводят 30 см 3 дистиллированной воды, пипеткой прибавляют по 1 см 3 раствора соляной кислоты, 1,0; 2,0; 3,0; 4,0; 6,0 см 3 раствора железа концентрации 10 мкг/см 3 , по 2 см 3 раствора сульфосалицшювой кислоты и по 5 см 3 раствора аммиака. После прибавления каждого реактива раствор перемешивают. Объем раствора доводят водой до метки и перемешивают. Одновременно готовят контрольный раствор: в мерную колбу вместимостью 50 см 3 вводят 30 см 3 воды, 1 см 3 соляной кислоты, прибавляют 2 см 3 раствора сульфосалициловой кислоты и далее поступают, как описано выше.
Оптическую плотность градуировочных растворов измеряют через (10±1) мин в кюветах с толщиной поглощающего свет слоя раствора 50 мм при длине волны 434 нм по отношению к контрольному раствору. Градуировку прибора допускается проводить по методу наименьших квадратов.
По полученным результатам строят градуировочный график, откладывая по оси абсцисс введенную в градуировочные растворы массу железа в микрограммах, на оси ординат - соответствующие значения оптических плотностей. Градуировочный график проверяют 1 раз в квартал, а также при замене реактивов или приборов.
Проведение анализа
Навеску анализируемой соляной кислоты массой (20±1) г количественно переносят в мерную колбу вместимостью 250 см 3 , споласкивая стаканчик несколько раз водой, доводят объем раствора водой до метки и перемешивают. Результаты взвешивания записывают с точностью до второго десятичного знака.
Пипеткой отбирают для марок А и Б высшего сорта по 25 см 3 , а для марки Б 1-го сорта - 2,5 см 3 приготовленного раствора, переносят в мерную колбу вместимостью 50 см 3 добавляют 2 см 3 раствора сульфосалициловой кислоты и перемешивают. Затем прибавляют 10 см 3 раствора аммиака, доводят объем водой до метки и перемешивают.
Контрольный раствор готовят, как описано в 6.6.3.2. Через (10±1) мин измеряют оптическую плотность и, пользуясь градуировочным графиком, находят массу железа в анализируемом растворе в микрограммах.
Обработка результатов
Массовую долю железа Х 1 %, вычисляют по формуле:
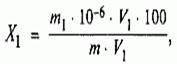
где m 1 - масса железа в анализируемом растворе, найденная по градуировочному графику, мкг;
m - масса навески соляной кислоты, взятая для выполнения анализа, г;
V - объем раствора соляной кислоты, полученный после разбавления массы соляной кислоты, см 3 ;
V 1 - объем разбавленного раствора соляной кислоты, взятый для выполнения анализа, см 3 .
За результат анализа принимают среднеарифметическое результатов двух параллельных измерений, расхождения между которыми не должны превышать 0,0005 %. Результаты определения округляют до четвертого десятичного знака.
Допускаемые расхождения между результатами, полученными в двух лабораториях, не должны превышать 0,0005 %. Абсолютная суммарная погрешность определения ±0,2 А, где А - результат определения при доверительной вероятности Р = 0,95 .
Определение массовой доли остатка после прокаливания
Массовая доля остатка после прокаливания при 600 °С измеряется весовым методом. Диапазон определения от 0,005 % до 0,100 %.
Аппаратура, растворы и реактивы:
Цилиндр 2-100 по ГОСТ 1770;
Чашка кварцевая типа КП вместимостью 100 см 3 по ГОСТ 1990S, платиновая или фарфоровая;
Эксикатор 2-190 мм, 250 мм по ГОСТ 25336;
Муфельная печь с термопарой, обеспечивающая поддержание температуры (600±10) °С;
Кислота серная по ГОСТ 4204, хл.;
Кальций хлористый, прокаленный при 250-300 °С;
Вода дистиллированная по ГОСТ 6709;
Часы песочные на 5 мин.
Подготовка к анализу
Чашку прокаливают в муфельной печи при температуре (600±10) °С в течение (5±1) мин. Затем чашку помещают в эксикатор с хлористым кальцием и вьщерживают в течение (30±5) мин. Охлажденную чашку взвешивают. Результаты взвешивания записывают с точностью до четвертого десятичного знака.
Проведение анализа
Цилиндром отбирают 85 см 3 анализируемой соляной кислоты и помещают в кварцевую чашку, добавляют 1 каплю серной кислоты и выпаривают на водяной бане почти досуха. Чашку с остатком нагревают на электроплитке до прекращения выделения паров серной кислоты. Выпаривание анализируемой кислоты и разложение серной кислоты можно проводить под инфракрасной лампой.
После этого чашку с остатком переносят в муфельную печь, предварительно нагретую до (600±10) °С, и прокаливают в течение (5±1) мин. Переносят чашку в эксикатор, выдерживают (30±5) мин и взвешивают.
Обработка результатов
Массовую долю остатка после прокаливания Х 2 %, вычисляют по формуле:
где m 1 - масса чашки с остатком после прокаливания, г;
m - масса пустой чашки, г;
V - объем пробы соляной кислоты, взятой для анализа, см 3 ;
p - плотность соляной кислоты, г/см 3 .
За результат анализа принимают среднеарифметическое результатов двух параллельных измерений, допускаемые расхождения между которыми не должны превышать 0,0006 %. Результаты параллельных определений округляют до 0,0001 %, результат определения - 0,001 %. Допускаемые расхождения между результатами, полученными в двух лабораториях, не должны превышать 0,0008 %. Абсолютная суммарная погрешность определения ± 0,0005 % при доверитель- ной вероятности Р = 0,95 .
5.2.6 Определение массовой доли свободного хлора
Метод основан на реакции окисления метилового оранжевого хлором:
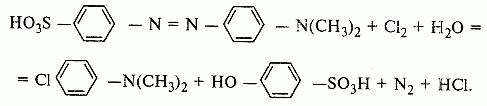 |
(6.5)
В результате окисления метилового оранжевого окраска его растворов становится менее интенсивной. Интенсивность окраски зависит от порядка смешивания растворов, поэтому анализируемую соляную кислоту добавляют последней при перемешивании. Метод отличается избирательностью, железо (III) мешает определению. Диапазон измерения 5·10 -4 - 8·10 -3 %.
Аппаратура, реактивы и растворы:
Колориметр фотоэлектрический лабораторный КФК или другого типа, обеспечивающий заданную чувствительность и точность;
Колбы мерные 2-25, 1000 по ГОСТ 1770;
Пипетки 1,5-1,2 по ГОСТ 29169;
Кислота соляная по ГОСТ 3118, х.ч., раствор (1:2);
Метиловый оранжевый (индикатор), раствор концентрации 0,1 г/дм 3 , готовят следующим образом: 0,1 г метилового оранжевого переносят в мерную колбу вместимостью 1000 см 3 , доводят объем раствора водой до метки и перемешивают. Результаты взвешивания записывают с точностью до второго десятичного знака.
Приготовление градуировочных растворов и градуировка фотоэлектроколориметра
В мерные колбы вместимостью 25 см 3 вводят 15 см 3 воды, пипеткой прибавляют 2,0; 1,6; 1,2; 0,8; 0,4 см 3 раствора метилового оранжевого, что соответствует 0; 10; 20; 30; 40 мкг хлора, добавляют по 1 см 3 раствора соляной кислоты, доводят объем раствора водой до метки и перемешивают.
Оптическую плотность полученных растворов измеряют на фотоэлектроколори-метре при толщине поглощающего свет слоя раствора 10 мм и при длине волны 490-505 нм. Раствор сравнения - дистиллированная вода.
По полученным данным строят градуировочной график, откладывая на оси абсцисс массу хлора в микрограммах, на оси ординат - соответствующее значение оптических плотностей.
Градуировочный график проверяют один раз в квартал, а также при замене реактивов или приборов.
Градуировку прибора допускается проводить по методу наименьших квадратов.
Проведение анализа
В мерную колбу вместимостью 25 см 3 помещают 15 см 3 дистиллированной воды, энергично перемешивая, пипеткой вводят 2 см 3 раствора метилового оранжевого, (0,5-2) см 3 анализируемой соляной кислоты, доводят объем раствора водой до метки и перемешивают. Оптическую плотность полученного раствора измеряют на фотоэлектроколориметре при толщине поглощающего свет слоя раствора 10 мм и длине волны 490-505 нм. Раствор сравнения - дистиллированная вода.
Массу хлора в микрограммах в кислоте находят по градуировочному графику.
Обработка результатов
Массовую долю свободного хлора Х 3 , %, вычисляют по формуле:
где m - масса хлора в анализируемой соляной кислоте, найденная по градуировочному графику, мкт;
V - объем соляной кислоты, взятый для выполнения анализа, см 3 ;
p - плотность анализируемой соляной кислоты, г/см 3 .
За результат анализа принимают среднеарифметическое результатов трех параллельных измерений, расхождения между которыми не должны превышать 0,0003 %, Результаты определения округляют до 0,0001 %.
Допускаемые расхождения между результатами, полученными в двух лабораториях, не должны превышать 0,0005 %.
Абсолютная суммарная погрешность определения находится в диапазоне ±0,2 А, где А - результат определения при доверительной вероятности Р = 0,95
.
5.3 Транспортировка и хранение
Масса пакета не должна превышать грузоподъемность поддона.
В железнодорожном вагоне пакеты устанавливают так, чтобы вместимость (грузоподъемность) вагона была использована полностью.
Техническую синтетическую соляную кислоту хранят в герметичных резервуарах изготовителя и потребителя, изготовленных из материалов, стойких к соляной кислоте.
Срок хранения продукта неограничен.
Заключение
В заключение курсовой работы можно сделать некоторые выводы.
Соляная кислота – это прозрачная бесцветная или желтоватая жидкость без взвешенных или эмульгированных частиц
Соляная кислота применяется в химической, медицинской, пищевой промышленности, цветной и черной металлургии.
Соляная кислота (хлороводородная кислота), по химическому составу отвечающая хлориду водорода находит широкое применение в ряде отраслей народного хозяйства.
В промышленности соляную кислоту получают следующими способами:
Сульфатным;
Синтетическим,
Из абгазов (побочных газов) ряда процессов.
Техническая синтетическая соляная кислота должна изготовляться в соответствии с требованиями стандартов по технологическому регламенту, утвержденному в установленном порядке.
Техническую синтетическую соляную кислоту в соответствии с правилами перевозки опасных грузов транспортируют:
Наливом в железнодорожных цистернах ("Правила перевозки опасных грузов № 340", ч. 2, раздел 41);
Упакованную в бочки и бутыли в ящиках - железнодорожным транспортом в крытых вагонах повагонными отправками ("Правила перевозки опасных грузов № 340", ч. 2, раздел 42);
Упакованную в контейнеры, бочки, бутыли - автомобильным и водным транспортом.
Бочки и бутыли при отгрузке пакетами формируют на плоских деревянных поддонах по ГОСТ 9557-87 в соответствии с требованиями ГОСТ 21650, ГОСТ 24597 и ГОСТ 26663.
Список ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
1. Асатурьян Н.Г., Голь В.Н. Справочник товароведа непродовольственных товаров.М.: Экономика, 1990. - 349 с.
2. Брозовский Д.И. Товароведение непродовольственных товаров. М.: ЮНИТИ, 1990. - 398 с.
3. Демидова Г.А. и др. «Товароведение непродовольственных товаров», Т. 4, М. 1987г.
4. Демидова Г.А. Товароведение непродовольственных товаров. М.:Луч, 2000.- 487 с
5. Епифанцева В.В. Химическая промышленность Беларуси, - Мн.: Вышэйшая школа, 2005. – 274с.
6. Каролькова Р.В. Химическая промышленность, - СПб.:Питер, 2005. – 285с.
7. Лифиц И.М. Основы стандартизации, метрологии, сертификации: Учебник. – М.: Юрайт, 1999. – 252 с.
8. Постановление Комитета по стандартизации, метрологии и сертификации при Совете Министров Республики Беларусь № 35 от 30.06.2004 года
9. Сыцко В.Е., Дрозд М.И. Товароведение непродовольственных товаров.Мн.: Вышэйшая школа, 2005. - 663 с.
10. Экономическая газета - №12 - 2005г
Азотная кислота - одноосновная кислота, которая имеет вид жидкости с желтоватым оттенком. В основном, используется в качестве реактива, но существует множество сфер, в которых кислота тоже нашла применение. Вещество имеет резкий неприятный запах. Азотная кислота относится к веществам 3 класса опасности. Поэтому необходимо серьезно относится к хранению и использованию реактива. Азотная кислота обладает способностью к окислению большинства металлов. Работа с кислотой требует наличие специализированой одежды: комбинезон, обувь, перчатки, респиратор, очки. Работая с кислотой стоит быть очень внимательным, ведь контакт вещества с кожей может привести к неприятным ощущениям, и даже к аллергии.
Применение азотной кислоты в промышленности
Благодаря своим свойствам области применения азотной кислоты весьма разнообразны:
- Химическая промышленность часто прибегает к помощи азотной кислоты. Искусственное волокно синтезируется благодаря участию в процессе азотной кислоты.
- Ракетно-космическая промышленность использует кислоту для создания ракетного топлива.
- Ювелирные изделия проверяются на подлинность с помощью азотной кислоты. При помощи данного химического вещества определяется проба золота.
- В металлургической промышленности так же используется азотная кислота, применение которой гарантирует растворение и травлю почти всех известных металлов.
Во многих известных Вам процессах участвует азотная кислота, применение в промышленности которой имеет особое значение.
Применение азотной кислоты в быту
Очищать ювелирные украшения возможно и в домашних условиях. Для этого используется азотная кислота. Применение в быту должно быть крайне осторожным, чтобы не допустить возможность взаимодействия кислоты с кожей. Если случилось так, что кислота все-таки попала на кожу, стоит промыть пораженную область водой из-под крана. Далее можно нейтрализовать кислоту при помощи нашатырного спирта. Азотная кислота в капельном поливе выступает в роли очистителя. Чтобы растворить осадок, или избавиться от накопления солей в капельной системе, необходимо использовать 60% азотную кислоту.
Применение азотной кислоты в медицине
В состав некоторых лекарственных препаратов входит азотная кислота. Применение в медицине химического вещества помогает бороться с заболеваниями кожи и желудочно-кишечного тракта. Так, 30% азотная кислота используется для борьбы с образовавшимися бородавками. Концентрация кислоты имеет особое значение, когда речь идет о здоровье человека. Для лечения язвенной болезни используется азотная кислота в виде солей висмута. Такое средство обладает вяжущими и антисептическими свойствами.
Применение азотной кислоты в сельском хозяйстве
Для того, чтобы урожай был богатым, многие агрономы используют минеральные удобрения. В состав некоторых из них сходит азотная кислота. Применение в сельском хозяйстве возможно в виде удобрения или селитры. Чтобы овощи и фрукты, которые подвергались воздействию удобрения, не приносили вреда здоровью человека, что их употребляет, необходимо четко расчитывать дозу удобрения. Избыток последних может привести к увеличенному накоплению нитратов в конечной продукции. Существует три вида азотных удобрений: аммиачные, нитратные и амидные. Удобрения имеют свойство к вымыванию на песчаных грунтах.
Помимо азотной кислоты в чистом виде, употребление нашли её производные - соли азотной кислоты, применение которых пользуется большим спросом, чем их исходник. Некоторые виды нитроэфиров входят в состав фармацевтических средств для борьбы со стенокардией. Нитроглицерин принимают люди, которые страдают коронарной недостаточностью.
Получение и применение азотной кислоты требует особой осторожности. Поэтому, она должна сохраняться в помещениях в которых присутствует вентиляционная система. Чтобы избежать неприятных ситуаций, емкость с азотной кислотой должна храниться вдали от обогревательных предметов. Нежелателен так же контакт со светом от солнца. Транспортировка кислоты должна осуществляться в герметично упакованных емкостях из стали. Для хранения используют алюминиевые тары.
Приобрести азотную кислоту в необходимом количестве вы можете в нашем специализированном магазине. Для просмотра товара перейдите по ссылке



