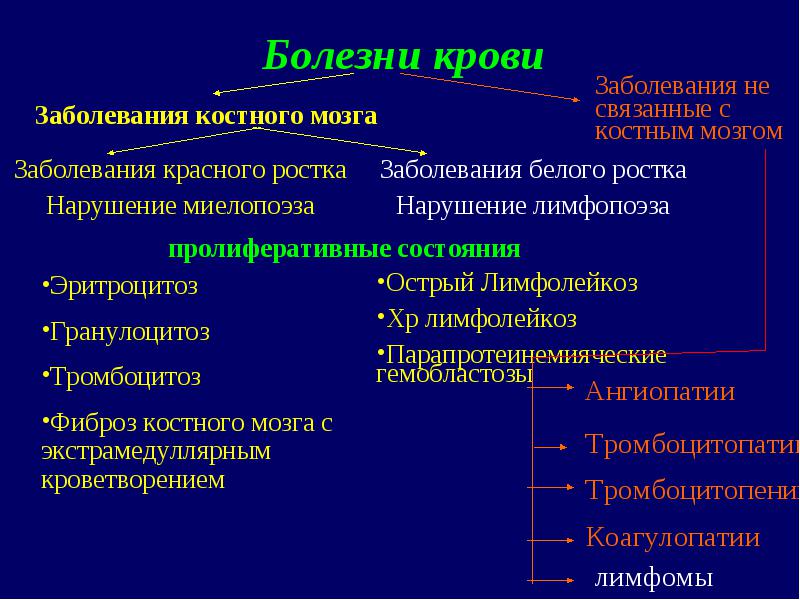
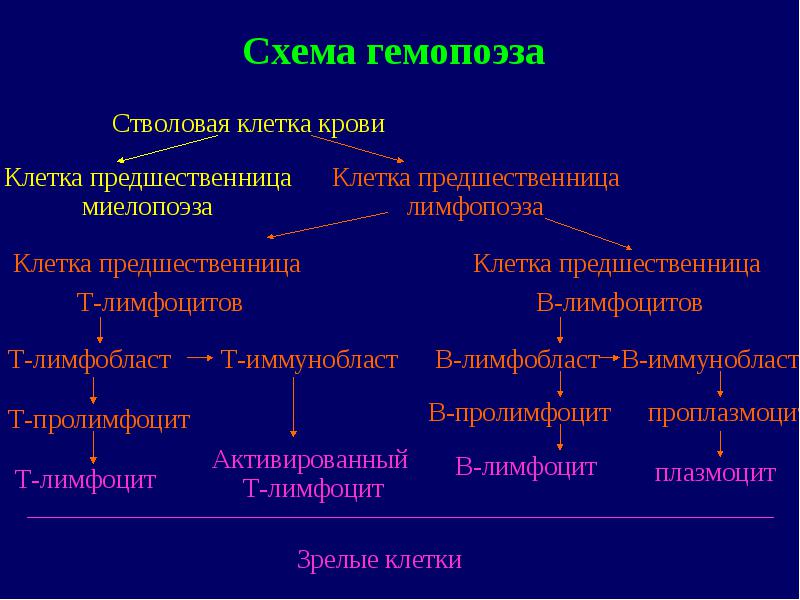


Limfoproliferatīvo slimību grupā ietilpst:
Akūta limfoblastiska leikēmija
Hroniska limfoleikoze
Limfogranulomatoze (Hodžkina limfoma)
Ne-Hodžkina limfomas (limfosarkomas)






Limfomu klīniskā aina
Intoksikācijas simptomi
- nerada pacientam nekādas subjektīvas sajūtas un to var konstatēt izlases izmeklējuma laikā
- vājums, nogurums, drudzis, svara zudums
- stipra svīšana, īpaši naktīs, nemotivēts ādas nieze un slikta tolerance pret asinssūcēju kukaiņu kodumiem
Audzēja progresēšanas simptomi
- Metastātisks sindroms (liels l/g)
- Imunoloģiskais sindroms (imūnā hemolītiskā anēmija, imūnā trombocitopēnija, vilkēdei līdzīgs sindroms)
- Samazināts imūnsistēmas stāvoklis (biežas baktēriju un vīrusu infekcijas)

Limfomu diagnostika
Asins analīzē:
- Bieži vien izmaiņu nav
- Var būt anēmija, trombocitēmija, leikocitoze (limfocitoze, eozinofīlija)
- Citopēnisks sindroms MTS limfomas gadījumā kaulu smadzenēs



Limfomu diagnostika
Radiācijas diagnostika
Papildu pētījumu metodes(imūnfenotipēšana ar plūsmas citometriju, citoģenētiskie un molekulāri ģenētiskie pētījumi)
Limfomu diagnostika
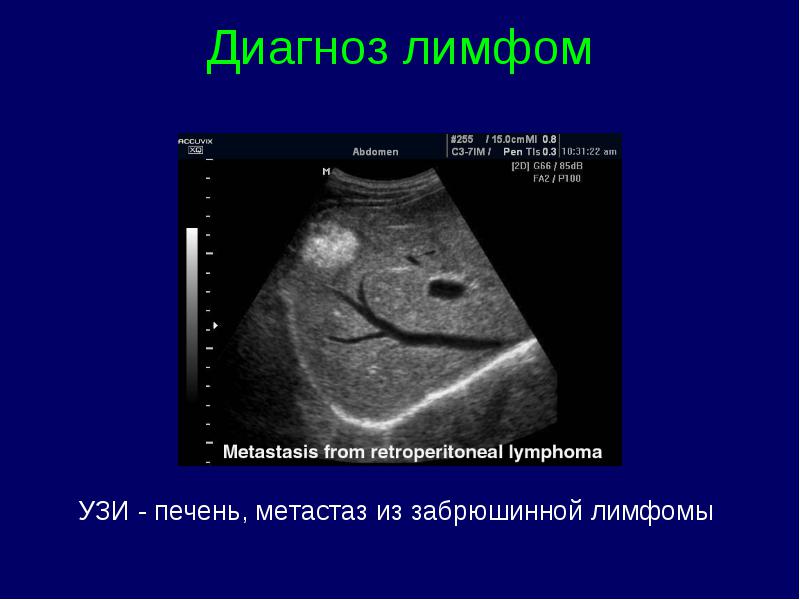
Limfomu diagnostika
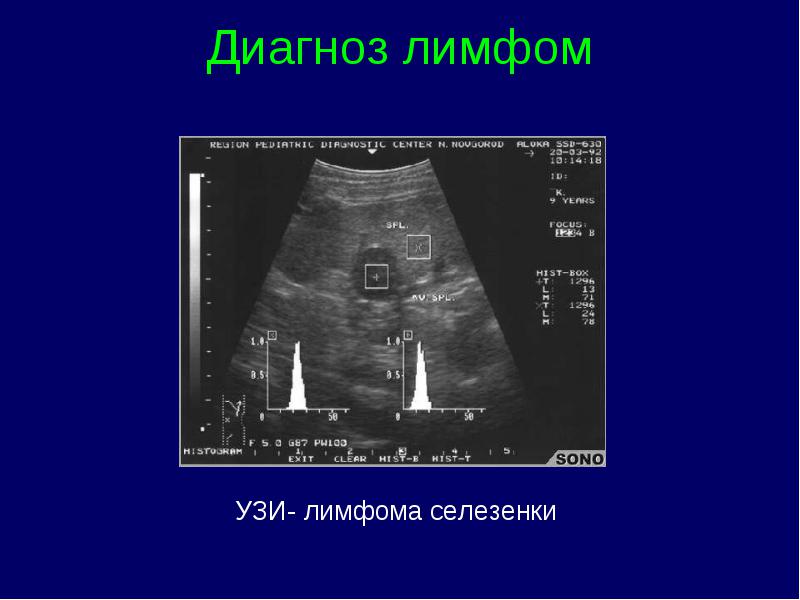
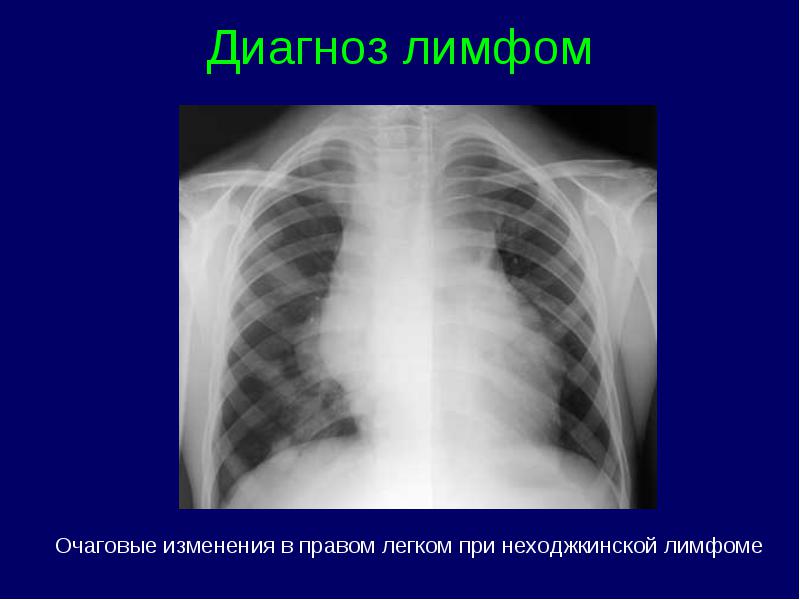
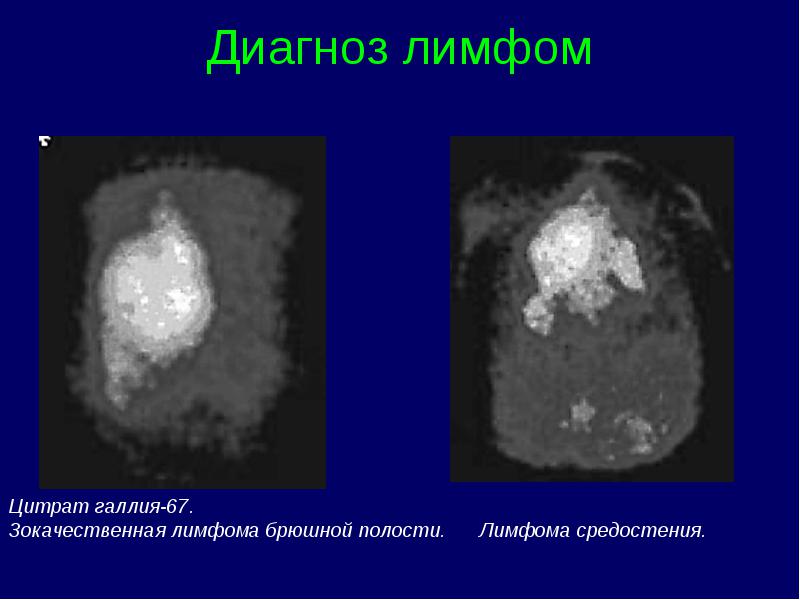
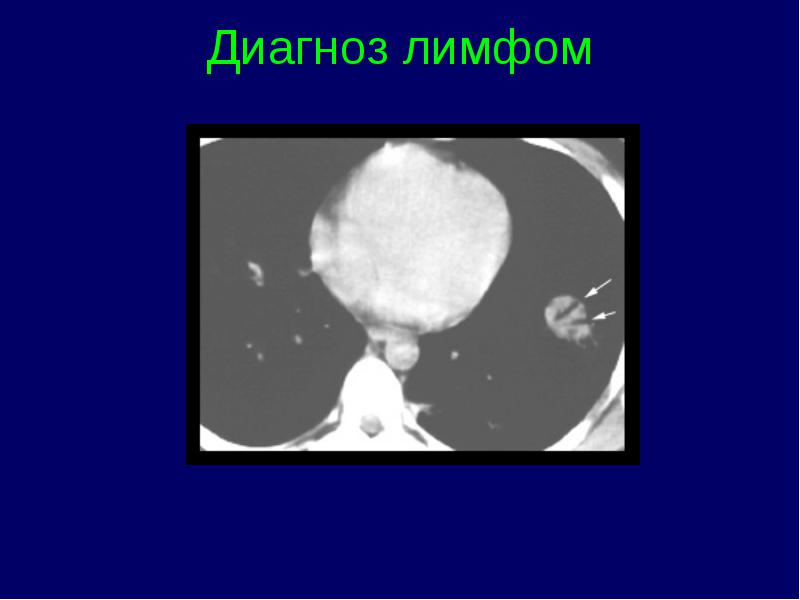
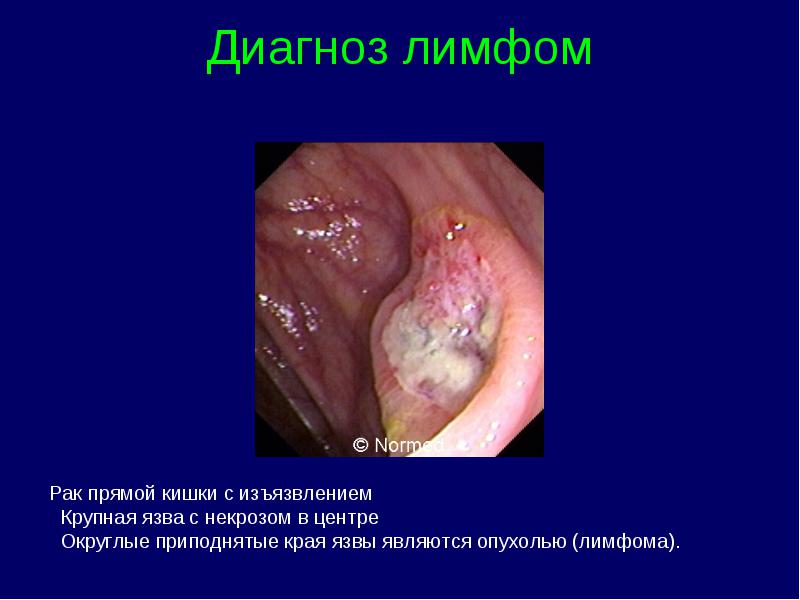
Limfomas stadijas klasifikācija
Intoksikācijas simptomi, kas nosaka A un B apakšstadiju:
nakts svīšana

Vienkāršota ne-Hodžkina limfomu diagnozes versija atbilstoši ļaundabīgo audzēju pakāpei:
Limfomas, kas sastāv no nenobriedušām šūnām (limfoblastiem), ir augstas pakāpes limfomas.
Limfomas, kas sastāv no vidēja brieduma šūnām (prolimfocītiem) - vidējas ļaundabīgo audzēju pakāpes limfoma.
Limfomas, kas sastāv no nobriedušām šūnām (limfocītiem), ir zemas pakāpes limfomas.

Limfomu ārstēšana
Polikemoterapija
Lielu devu ķīmijterapija ar hematopoētisko cilmes šūnu transplantāciju.
Staru terapija


Pacients P., 72 gadus vecs, ievietots hroniskas pneimonijas saasināšanās dēļ.
Pārbaudot, tiek palpēti limfmezgli, kas palielināti līdz vistas olai: dzemdes kakla, cirkšņa, paduses. Limfmezgli ir mīksti, starp tiem nav lodēti
Plaušas: kastes toņa perkusiju skaņa, abās pusēs izkaisīti sausi rales. Hepatosplenomegālija.
Asinis: Hb - 74 g / l, eritrocīti - 2,31012, retikulocīti - 20%, leikocīti - 5,0109: e - 1%, s / i - 2%, s / i - 17%, limfocīti - 79%, monocīti - 1%, ESR 60 mm/h, leikolīzes šūnas. Trombocīti - 100109.

interaktīvi jautājumi
1. Kāda slimība nav klasificēta kā limfoproliferatīva slimība:
- Akūta limfoleikoze
- Hroniska limfoleikoze
- Paraproteinēmiskās hemoblastozes
- Kaulu smadzeņu fibroze ar ekstramedulāru hematopoēzi
- Burkita limfoma

interaktīvi jautājumi
2. Kurš simptoms nenosaka A un B apakšstadiju:
- neizskaidrojama temperatūras paaugstināšanās līdz 38 ° C vakaros ar īsiem afibrilu periodiem
- nakts svīšana
- Matu izkrišana
- neizskaidrojams svara zudums vairāk nekā 10% sešos mēnešos

interaktīvi jautājumi
3. Ja kaulu smadzeņu punktā konstatē limfomas primārā fokusa šūnām morfoloģiski līdzīgas šūnas, jādomā par
Limfomas pārveide par leikēmiju
Limfomas metastāzes kaulu smadzenēs
Sprādzienbīstamas krīzes attīstība limfomas gadījumā

interaktīvi jautājumi
4. Kādā slimības stadijā konstatēts 5 limfmezglu grupu palielinājums diafragmas pretējās pusēs:

interaktīvi jautājumi
5. Kas var būt kaulu smadzeņu punktos ar Hodžkina limfomu
- normāls šūnu sastāvs
- Limfocitoze līdz 20%
- nosaka limfomu primārā fokusa šūnām morfoloģiski līdzīgas šūnas
- Visu hematopoēzes asnu kavēšana
- Noteikts ar sprādzieniem

LITERATŪRA
Rainbow N.L. Iekšējās slimības Mn: VSH, 2007, 365s
Pirogovs K.T. Iekšējās slimības, M: EKSMO, 2005
Sirotko V.L., Viss par iekšējām slimībām: mācību grāmata maģistrantiem, Mn: VSH, 2008

Literatūra
Abdulkadirovs K.M. un citi. Hematoloģiskie sindromi vispārējā klīniskajā praksē // "Elbi", Sanktpēterburga.-1999.-S.83-94
Hematoloģiskie sindromi klīniskajā praksē, Vjagorskaja Ya.I., Kijeva "Veselība", 1981 od
Vorobjovs A.I. Ceļvedis hematoloģijā.// "Newdiamed", Maskava.-2003.-T1.
Wood M.E., Bunn P.A. Hematoloģijas un onkoloģijas noslēpumi// "Binom" - Maskava.-2001.-85.-93.lpp.
Guseva S.A., Vozņuks V.P. Asins sistēmas slimības. Katalogs. // "MEDpress-inform".-Maskava.-2004.-317.-356.lpp.
Iekšējās slimības, ko rediģēja Ryabva S.I., Almazova V.A., Shlyakhto E.V., Sanktpēterburga, SpetsLit, 2000
Klīniskā onkohematoloģija, rediģēja Volkova M.A., Maskava, "Medicīna", 2001
Šifmens F.D. Asins patofizioloģija. // Binom.-Maskava.-2000.-71-123.lpp., 343-358
-
Izgudrojums attiecas uz medicīnu, proti, onkoloģiju, un to var izmantot ne-Hodžkina limfomu un granulomatozes ārstēšanai. Ir ierosināts veikt plazmaferēzi 1. un 8. ārstēšanas dienā, uzņemt autoplazmu 200-250 ml apjomā, veikt ķīmijterapijas kursu: vinkristīns - 1 mg, doksorubicīns - 40-50 mg, ciklofosfamīds - 600-800 mg. 1. un 8. dienā citostatiskos līdzekļus sajauc ar autoplazmu, inkubē 37 o C 1 stundu un atkārtoti ievada pacientam, ārstēšanu veic uz prednizolona 40 mg/dienā lietošanas fona no 1. līdz 14. dienas iekšā un intramuskulāri. Metode ļauj palielināt ārstēšanas efektivitāti.
VIELA: izgudrojums attiecas uz medicīnu, proti, onkoloģiju, un to var izmantot limfogranulomatozes, ne-Hodžkina limfomu ar dažādu procesa izplatības stadiju, rezistentu formu un recidīvu ārstēšanai, kā arī blakusslimību klātbūtnē.
Zināma metode hematosarkomu ārstēšanai (sk. "Audzēju slimību ķīmijterapija Perevodčikovas N.I.M. redakcijā, 2000, 259. lpp.), kas izvēlēta kā analogs, kombinējot CHOP pretvēža zāles, ieskaitot ciklofosfamīdu 750 mg/m 2 un adriablastīnu 50 mg/m 2, vinkristīns 1,4 mg/m 2 intravenozi 1. ārstēšanas dienā, perorāli prednizolons 60 mg/m 2 no 1. līdz 5. ārstēšanas dienai, kursu atkārto ik pēc 3 nedēļām.nepieciešams būtiski samazināt standarta vienreizējo un kursa zāļu devas, imūnsupresīva iedarbība, kas neļauj ievērot plānotos režīmus un rezultātā negatīvi ietekmē limfoproliferatīvo slimību ārstēšanas efektivitāti.
Zināma metode lokāli progresējoša krūts vēža ārstēšanai (Autora darbs ... medicīnas zinātņu kandidāte Vladimirova L.Ju. "Neoadjuvanta ķīmijterapija ķermeņa dabiskajā vidē, izmantojot epitalamīna epifīzes peptīdu lokāli progresējoša krūts vēža kompleksā ārstēšanā" Rostova pie Donas, 2000, 10. lpp.), kuru izvēlējāmies kā prototipu, kas sastāv no tā, ka viena ķīmijterapijas zāļu deva tiek sajaukta ar 100-150 ml ķīmijterapijas zāļu, inkubēta 37 o C temperatūrā 1 stundu un ievada intravenozi pa pilienam 3 reizi nedēļā. Šī ārstēšanas metode ļāva uzlabot krūts vēža pacientu ārstēšanas efektivitāti, izmantot autoplazmas īpašības kā ķīmijterapijas zāļu iedarbības modifikatoru, tomēr tai bija izteikta toksicitāte, kas saistīta ar pakļaušanu strauji proliferējošām asinīm. šūnām un gļotādām, un neļāva ņemt paraugus vairāk par 100-150 ml autoplazmas. Autoplazmas ķīmijterapijas izmantošana dažādu ļaundabīgu slimību ārstēšanā, jo īpaši limfoproliferatīvo ļaundabīgo procesu ārstēšanā ar dažādu izplatības pakāpi ar slimību recidīviem, nav zināma. Šajā gadījumā gadījumiem ar vienlaicīgu patoloģiju ir īpašas klīniskas grūtības, kas rada nepieciešamību samazināt citostatisko līdzekļu devu un negatīvi ietekmē ķīmijterapijas efektu.
Izgudrojuma mērķis ir uzlabot tūlītējus un ilgtermiņa ārstēšanas rezultātus pacientiem ar limfoproliferatīvām slimībām.
Šis mērķis tiek sasniegts ar to, ka 1. un 8. ārstēšanas dienā tiek veikta plazmaferēze, tiek uzņemta autoplazma 200-250 ml daudzumā, tiek veikts ķīmijterapijas kurss: vinkristīns - 1 mg, doksorubicīns - 40- 50 mg, ciklofosfamīds - 600-800 mg 1. un 8. dienā, citostatiskos līdzekļus sajauc ar autoplazmu, inkubē 37 o C 1 stundu un atkārtoti ievada pacientam, ārstēšanu veic uz prednizolona 40 lietošanas fona. mg / dienā no 1. līdz 14. dienai iekšā vai intramuskulāri.
Izgudrojums ir jauns, jo nav zināms no medicīnas līmeņa medikamentozās terapijas jomā onkohematoloģijā.
Izgudrojuma novitāte slēpjas apstāklī, ka ķīmijterapijas kursam 1. un 8. ārstēšanas dienā tiek veikta plazmaferēze, diskrēta vai nepārtraukta (aparatūras filtrēšana vai centrifūga), tiek ņemta autoplazma, ko inkubē ar vienreizējām devām. ķīmijterapijas zāles 37 o C temperatūrā 1 stundu un ievada atkārtoti.
Ķīmijterapijas zāļu ieviešana uz autoplazmas noved pie tā, ka ķīmijterapijas zāļu-olbaltumvielu komplekss iegūst jaunas īpašības, kas nodrošina tā augsto afinitāti pret audzēja audiem, tādējādi nodrošinot metodes augstu efektivitāti. Autoplazmas eksfūzijai piemīt arī imūnkorektīvas, detoksikācijas un reokorektīvas īpašības, kas nespecifisku ietekmju dēļ vēl vairāk paaugstina ārstēšanas efektivitāti. Izmantojot paša organisma vidi, tiek pilnībā novērstas transfūzijas un alerģiskas reakcijas. Šī metode palielina metodes terapeitiskās iespējas un ļauj ārstēt pacientus ar limfogranulomatozi, ne-Hodžkina limfomām, tai skaitā ar recidīviem, rezistentām formām. Šīs metodes īpašā klīniskā vērtība slēpjas veiksmīgā pacientu ar blakusslimībām ārstēšanā, jo ļauj nesamazināt devu, kas pozitīvi ietekmē ārstēšanas efektu.
Izgudrojumam ir izgudrojuma pakāpe, jo speciālistam onkologam-ķīmijterapeitam tas nepārprotami neizriet no mūsdienu medicīnas līmeņa šajā limfoproliferatīvo slimību ārstēšanas jomā. Izgudrojums nav acīmredzams, jauns, neizriet no mūsdienu medicīnas līmeņa, nav zināms ne pasaulē, ne pašmāju literatūrā.
Izgudrojums ir rūpnieciski pielietots, jo var tikt izmantots veselības aprūpē, ārstniecības iestādēs, kas nodarbojas ar onkoloģisko slimību ārstēšanu, onkoloģijas pētniecības institūtos, onkoloģijas ambulatoros.
Limfoproliferatīvo slimību ārstēšanas metode ir šāda.
Pacientam ar ļaundabīgo limfomu reizi nedēļā tiek veikta plazmaferēze ar jebkuru no metodēm - diskrētu vai nepārtrauktu aparātu centrbēdzes vai filtrēšanu, autoplazmu ņem 200-250 ml daudzumā, ķīmijterapijas zāles izšķīdina 10 ml fizioloģiskā šķīduma. šķīdums, injicēts flakonā ar autoplazmu, inkubēts 37 o C temperatūrā 60 min un atkārtoti ievadīts intravenozi pa pilienam.
Pie mums lietotā pretaudzēju zāļu kombinācija ir paredzēta 2 nedēļām un tiek ievadīta devās: vinkristīns 1 mg, doksorubicīns 40-50 mg, ciklofosfamīds 600-800 mg intravenozi pilināmā veidā 1. un 8. dienā; prednizolons 40 mg/dienā iekšķīgi no 1. līdz 14. ārstēšanas dienai.
Pirms un pēc plazmaferēzes tiek kontrolēti eritrocītu, hemoglobīna, hematokrīta, leikocītu formulas, trombocītu, PTI, kopējā proteīna rādītāji. Ievērojiet pacienta vispārējo stāvokli. Turklāt viņi kontrolē vispārīga analīze asinis un urīns vismaz 2 reizes nedēļā, EKG pirms un pēc ķīmijterapijas.
Plazmaferēzes gadījumā diskrētā veidā tiek savākti 250-300 ml autologo asiņu, kuras centrifugē pie apgr./min - 1500 apgr./min 40 minūtes, iegūto supernatanta plazmu atdala un izmanto ķīmijterapijas medikamentu ievadīšanai, un šūna. nogulsnes tiek ievadītas atkārtoti.
Veicot aparatūras plazmaferēzi, tika izmantots ADM/ABM 08 monitors, PlS filtrs un standarta lielceļu sistēmas. Asinsvadu piekļuve - ar centrālo vai perifēro vēnu kateterizāciju. Kombinēta heparinizācija pēc pirmsoperācijas hemokorekcijas ar kristaloīdu šķīdumiem, tiek ņemta autoplazma.
Metodes specifiska pielietojuma piemēri limfoproliferatīvo slimību ārstēšanai.
Pacients D., 47 gadus vecs, un. b. 10959/e, atradās RNIOI ārstēšanā kopš 26.09.1997. ar diagnozi Limfoblastiska limfosarkoma ar abās pusēs pieauss, submandibulāro, kakla limfmezglu bojājumiem, videnes, Art. MB. Diagnoze apstiprināta morfoloģiski (histoloģiskā izmeklēšana 491658 - 660 datēta ar 26.09.1997.). Pavadošās slimības: hipertrofiska kardiomiopātija, HF I stadija, hronisks bronhīts, hronisks pielonefrīts, sekundāra anēmija.
No 2.12.1997 līdz 12.12.1997 tika veikts ķīmijterapijas kurss autoplazmai ar tās izstrādi ar diskrētu plazmaferēzi. Kursa devas bija: doksorubicīns 80 mg, vinkristīns 2,5 mg, ciklofosfamīds 1200 mg, prednizolons 40 mg dienā iekšķīgi no 1. līdz 14. ārstēšanas dienai.
Komplikācijas: II pakāpes alopēcija, I pakāpes leikopēnija.
Ārstēšanas rezultātā pēc 2 nedēļām tika novērota pilnīga perifēro limfmezglu (pieauss, submandibulārā, kakla) regresija, ko pirms ārstēšanas pārstāvēja viens, blīvs, nekustīgs konglomerāts 75 cm, tika konstatēta videnes limfmezglu regresija. fluorogrammā par vairāk nekā 80%, pazuda intoksikācijas pazīmes (temperatūra normalizējās, pazuda svīšana), ESR samazinājās no 47 pirms ārstēšanas līdz 15 mm/h, pazuda klepus, uzlabojās vispārējais stāvoklis. SOD 36 Gy bojājumu gadījumā pacientam tika veikta DHT.
Tādējādi standarta 6 ķīmijterapijas un DHT kursu vietā pacients saņēma 1 ķīmijterapijas un DHT kursu. Pacients tika novērots RNIOI 3,5 gadus bez slimības progresēšanas pazīmēm.
Pacients L., 30 gadus vecs, I.B. 4063/n.
Kopš 2001. gada 20. marta viņš ārstējas RNIOI ar diagnozi limfogranulomatoze (limfoīdu izsīkums) ar videnes limfmezglu un plaušu sakņu, kā arī liesas bojājumiem. Art. III B.
Pacientam tika veikti 4 ķīmijterapijas kursi uz autoplazmas ar tās nepārtrauktas filtrēšanas aparatūras plazmaferēzi. Kursa devas bija: doksorubicīns 100 mg, ciklofosfamīds 1200 mg, vinkristīns 3 mg, prednizolons 40 mg dienā iekšķīgi no 1. līdz 14. dienai.
Komplikācijas: alopēcija II pakāpe, slikta dūša I pakāpe 2. un 3. kursa laikā.
Pēc pirmā kursa tika atzīmēts: pilnīga perēkļu regresija liesā un tā lieluma samazināšanās līdz normālam, videnes limfmezgli un plaušu saknes samazinājās par 70%, temperatūra normalizējās, ESR samazinājās. no 50 līdz 4 mm/h, hemoglobīna līmenis paaugstinājās no 98 līdz 120 g/l . Šobrīd pacientam tiek veikts DHT kurss pēc radikālas programmas.
Tādējādi piemēri parāda plazmas paraugu ņemšanas iespēju ar diviem Dažādi ceļi plazmaferēze gan pacientiem ar limfogranulomatozi, gan pacientiem ar ne-Hodžkina limfomām.
Pirmais piemērs parāda, ka pacientam ar vienlaicīgu patoloģiju šāds kurss ir adekvāts ķīmijterapijas efekts, kas ļauj sasniegt augstu ārstēšanas efektivitāti gan tūlītēju rezultātu, gan 3 gadu dzīvildzes rezultātu ziņā. Otrais piemērs parāda augstu tiešo efektu, spēju noteikt radikālas ārstēšanas laiku pacientam ar limfogranulomatozi, kuram ir nelabvēlīgs slimības morfoloģiskais variants - limfoīdo izsīkums.
Limfoproliferatīvo slimību ārstēšanas metodes tehniskā un ekonomiskā efektivitāte sastāv no ārstēšanas efektivitātes paaugstināšanas, izmantojot autoplazmas modificējošās īpašības, nevis palielinot pretaudzēju ķīmijterapijas zāļu devas. Šīs pieejas pozitīvo pusi nosaka ne tikai ķīmijterapijas toksiskās ietekmes samazināšanās uz pacienta organismu, bet arī medikamentu izmaksu samazināšanās. Autoplazmas ķīmijterapijai piemīt imūnmodulējošas īpašības un tā ļauj īsā laikā sasniegt izteiktu klīnisko efektu, kas padara tās lietošanu ekonomiski izdevīgu un ļauj tuvināt staru terapijas laiku, kā arī uzlabot ilgtermiņa ārstēšanas rezultātus, palielināt dzīvildzi. likmes.
Metode limfoproliferatīvo slimību ārstēšanai, tai skaitā polikemoterapija un ķīmijterapijas zāļu intravenoza pilienveida ievadīšana, kas raksturīga ar to, ka ārstēšanas 1. un 8. dienā tiek veikta plazmaferēze, autoplazmas uzņemšana 200-250 ml apjomā, kurss tiek veikta ķīmijterapija: vinkristīns - 1 mg, doksorubicīns - 40-50 mg, ciklofosfamīds - 600-800 mg 1. un 8. dienā, citostatiskos līdzekļus sajauc ar autoplazmu, inkubē 37 o C temperatūrā 1 stundu un atkārtoti ievada pacientam, ārstēšana tiek veikta, ņemot vērā prednizolona lietošanu 40 mg / dienā ar 1 1. līdz 14. dienu iekšā un intramuskulāri.
Līdzīgi patenti:
Izgudrojums attiecas uz jaunām orto-sulfonamidobicikliskām heteroarilhidroksāmskābēm ar formulu kur W un X abi ir oglekļa atoms, T ir slāpekļa atoms, U ir CR1, kur R1 ir ūdeņraža atoms, vai alkilgrupa, kas satur 1-8 oglekļa atomus, P ir -N(CH2R5). )-SO2-Z, Q ir -(C=O)-NHOH un ir benzola gredzens vai heteroarilgredzens ar 5-6 atomiem gredzenā, kas var saturēt 0-2 heteroatomus, kas izvēlēti no slāpekļa, skābekļa un sēra. , papildus slāpekļa heteroatomam, kas apzīmēts ar W; kur benzola vai heteroarilgredzens var neobligāti saturēt vienu vai divus R1 aizvietotājus, ja nepieciešams; Z ir fenilgrupa, kas neobligāti ir aizvietota ar fenilgrupu, C1-C8 alkilgrupu vai OR2 grupu; R1 ir halogēna atoms, C1-C8 alkilgrupa, C2-C6 alkenilgrupa, C1-C4 perfluoralkilgrupa, fenilgrupa, kas pēc izvēles aizvietota ar 1-2 -OR2 grupām, -NO2 grupa, -(CH2)nZ grupa, kur Z ir fenilgrupa un n=1- 6, tienilgrupa un -OR2 grupa, kur R2 ir alkilgrupa ar 1-8 oglekļa atomiem; R2 ir alkilgrupa ar 1-8 oglekļa atomiem, fenilgrupa, kas pēc izvēles ir aizvietota ar halogēnu, vai heteroarilgrupa, kas satur 5-6 gredzena atomus, ieskaitot 1-2 heteroatomus, kas izvēlēti no slāpekļa, skābekļa un sēra atoma; R5 ir ūdeņraža atoms, alkilgrupa ar 1-8 oglekļa atomiem, fenilgrupa vai heteroarilgrupa, kas gredzenā satur 5-6 atomus, ieskaitot 1-2 heteroatomus, kas izvēlēti no slāpekļa, skābekļa un sēra atoma; vai to farmaceitiski pieņemami sāļi
Izgudrojums attiecas uz savienojumiem ar formulu I vai formulu II, kur R1 apzīmē N(R10)(R11); R2 ir tio-zemākā alkilgrupa; katrs no R3 un R5 neatkarīgi ir CH2 vai C(O); R4 ir aizvietota vai neaizvietota tionu zemākā alkilgrupa, kur aizvietotājs ir CH2NHC(O)R13 un ir pievienots minētajai tiogrupai; R6 ir sintētiska heteroaromātiska α-aminoskābes atlikums; R7 ir dabiska vai sintētiska α-aminoskābes atlikums; R8 ir OH vai zemākā alkoksigrupa vai kopā ar R7 veido homoserīna laktonu; R9 ir H; katrs no R10 un R11 neatkarīgi apzīmē H; R12 ir aizvietots vai neaizvietots fragments, kas izvēlēts no arilgrupas, aril-zemākās alkilgrupas, kur aizvietotāji ir viena vai vairākas zemākās alkilgrupas vai halogēna atoms; R13 ir zemākā alkilgrupa; R18 ir H; ar nosacījumu, ka, ja R4 ir neaizvietota tionu zemākā alkilgrupa, brīvās tiogrupas no R2 un R4 var veidot disulfīda saiti; vai tā farmaceitiski pieņemami sāļi
Izgudrojums attiecas uz stirilsulfona savienojumiem ar formulu (I), kur n ir nulle vai viens; R1 ir izvēlēts no rindas, kas sastāv no hlora, fluora vai broma atoma; un R2 ir izvēlēts no rindas, kas sastāv no hlora, fluora un broma atoma; R3 ir izvēlēts no rindas, kas sastāv no ūdeņraža atoma un fluora atoma; abiem radikāļiem R1 un R2 nav jābūt hlora atomiem, ja R3 ir ūdeņraža atoms; un R1 nav jābūt hlora atomam, ja R2 ir fluora atoms un R3 ir ūdeņraža atoms tajā pašā savienojumā
Klīniski un morfoloģiski neviendabīga slimību grupa, kuras patoloģiskā procesa pamatā galvenokārt notiek ādā ļaundabīga limfocītu proliferācija ir limfoproliferatīvas slimības. Izlasiet rakstu par to, kā attīstās limfoproliferatīvās slimības un kāpēc.
Kas ir limfoproliferatīvās slimības?
Ļaundabīgo limfomu neviendabīgums tika noteikts atkarībā no proliferējošā limfocīta veida, piederības noteiktai populācijai un apakšpopulācijai.
Limfocītu sadalījums ādā pēc fenotipiem pacientiem ar limfoproliferatīvām slimībām ir tāds pats kā veseliem cilvēkiem: T-limfocīti lokalizējas galvenokārt epidermā un dermas augšējos slāņos, bet B-limfocīti - vidus un dziļajos slāņos. dermā. Attiecīgi T-šūnu audzēji galvenokārt aizņem dermas augšējos slāņus, savukārt B-limfoproliferatīvie procesi notiek dermas dziļajos slāņos un tiem nav epidermotropa rakstura. Ādas T-šūnu limfomu (TKL) skaits ievērojami pārsniedz B-šūnu limfomu (BCL) skaitu; T-limfomas veido 65% no visām ļaundabīgajām ādas limfomām, B-limfomas - 25%, bet neklasificētās limfomas - 10%.
Visbiežāk šīs limfoproliferatīvās slimības attīstās gados vecākiem cilvēkiem, lai gan ir atsevišķi saslimšanas gadījumi pat bērniem. Vīrieši cieš no limfoproliferatīvām slimībām 2 reizes biežāk nekā sievietes.
Kā attīstās limfoproliferatīvās slimības?
Slimības etioloģija nav noskaidrota. Kā etioloģisks faktors ādas limfoproliferatīvo slimību attīstībā pašlaik tiek uzskatīti retrovīrusi, piemēram, cilvēka limfotropais I tipa vīruss (HTVL-I), kas izraisa pieaugušo T-šūnu leikēmija. Visbiežāk sastopamās limfoproliferatīvās ādas slimību formas Mycosis fungoides attīstība ir saistīta ar retrovīrusu C, kas tiek konstatēts pacientiem ādā, perifērajās asinīs un Langerhansa šūnās. Antivielas pret HTVL-I tiek konstatētas daudziem pacientiem ar sēnīšu mikozi.
Iespējama iedzimto faktoru loma. Piemēram, histo-saderības antigēnus B-5 un B-35 bieži konstatē pacientiem ar ļoti ļaundabīgām ādas limfomām, A-10 mazāk agresīvām limfomām un B-8 pārsvarā pacientiem ar eritrodermisko fungoīdu mikozi.
Ilgstošas hroniskas dermatozes, piemēram, neirodermīts, atopiskais dermatīts, psoriāze u.c., veicina limfocītu ilgstošu noturību iekaisuma infiltrātos, kas uz veicinošo faktoru ietekmes fona pavājinātas imūnsistēmas uzraudzības apstākļos var veicina ļaundabīgu limfocītu klona parādīšanos un līdz ar to ļaundabīga proliferācijas procesa attīstību.
Jonizējošais starojums, UV starojums, dažādi ķīmiski savienojumi ar kancerogēnām īpašībām un daži alergēni spēlē noteiktu lomu limfoproliferatīvo slimību ģenēzē. Šie faktori var izraisīt "genotraumatisko" limfocītu klona parādīšanos proto-onkogēnu aktivācijas vai audzēja supresora gēna inaktivācijas dēļ un tādējādi ierosināt limfocītu ļaundabīgo audzēju procesu.
Kā radiācijas ietekmē attīstās limfoproliferatīvās slimības?
Imunopatoloģiskās reakcijas brīvprātīgajiem ar limfoproliferatīvu ādas slimību simptomiem ādā veic limfocīti un mikrovides šūnas: keratinocīti un Langerhansa šūnas. Limfocītu šūnām ir spēja nepārtraukti recirkulēt ādā. Šo šūnu galvenā funkcija ir antigēna materiāla izvadīšana. Limfocītu recirkulācijas līmenis hroniskas antigēnas stimulācijas laikā palielinās par 10 vai vairāk reizēm, kas izraisa palielinātu limfocītu pieplūdumu ādā. No vienas puses, šis process ir noderīgs, jo limfocīti ir iesaistīti imūnās aizsardzības reakcijās, bet, no otras puses, palielinās limfocītu mutanta klona parādīšanās risks.
Kā attīstās limfoproliferatīvās slimības - slimības attīstības mehānisms
Ādas TCL dominē T-helpera limfocītu proliferācija, kuru funkcionālās un membrānas īpašības ir līdzīgas veseliem T-palīdzības limfocītiem.
Tas ļauj viņiem ilgstoši veikt tām raksturīgās imunoloģiskās funkcijas. Turklāt šo limfocītu membrānas ekspresē ar ādu saistīto limfocītu antigēnu, kas veicina T-palīgu šūnu ilgtermiņa afinitāti pret ādu. Tomēr, palielinoties audzēja klona masai, tiek zaudētas limfocītu funkcionālās īpašības, jo īpaši limfocītu funkcionālais antigēns (LFA-1). Tajā pašā laikā uz limfoproliferatīvo ādas slimību fona uz limfocītu šūnu membrānām parādās proliferējošo šūnu kodolantigēns (Ki-67 - limfocītu ļaundabīgo audzēju marķieris), un tiek inaktivēti audzēju nomācošie gēni (P-53). .
Šie faktori liecina par pretaudzēju uzraudzības samazināšanos, afinitātes zudumu, noved pie audzēja šūnu izplešanās dziļajos dermas slāņos un bieži vien iekšējie orgāni. Šobrīd ir noteikta īpaša loma audzēju transformācijā un T-limfocītu (mikrovides šūnu) proliferācijā. Langerhansa šūnas un keratinocīti. Pirmie ir svarīga ādas makrofāgu sistēmas sastāvdaļa, kas savukārt ir daļa no imūnās uzraudzības sistēmas. Šo šūnu galvenā funkcija ir sniegt antigēnu informāciju T-limfocītiem. Turklāt limfoproliferatīvo ādas slimību gadījumā Langerhansa šūnas spēj ietekmēt T-limfocītu diferenciāciju un proliferāciju un stimulēt citotoksisku limfocītu veidošanos. Šīs Langerhansa šūnu funkcijas tiek veiktas citokīnu, galvenokārt interleikīna-6, sintēzes dēļ.
Kā attīstās limfoproliferatīvās slimības - histoloģiskie simptomi
Ar ilgstošu antigēnu, iespējams, vīrusu stimulāciju, notiek Langerhansa šūnu skaita samazināšanās un to funkcionālās lietderības samazināšanās, kas izjauc imūno uzraudzību un tādējādi noved pie ļaundabīgā T-limfocītu klona izdzīvošanas un paplašināšanās. Ir zināms, ka keratinocīti ievērojami uzlabo Langerhansa šūnu aktivitāti, "prezentējot" antigēnus T-limfocītiem.
Turklāt tie spēj sintezēt citokīnus, no kuriem funkcionāli nozīmīgākais ir interleikīns 1 (IL-1). Ir noskaidrots, ka IL-1 ir identisks epidermas timocītu aktivējošajam faktoram (ETAF) un spēj aktivizēt T-limfocītus. Tieši ar palielinātu šī citokīna ražošanu pacientiem ar limfoproliferatīvām ādas slimībām limfocītu pieplūdums bojājumiem ir saistīts ar sekojošu eksocitozi epidermā līdz pat Potrier mikroabscesu veidošanās tajā, kā arī limfocītu proliferāciju epidermā. dermā. IL-1 stimulētie limfocīti sintezē citu citokīnu, IL-2 (T-šūnu augšanas faktoru), kam ir galvenā nozīme ādas TCL patoģenēzē. Paaugstināta IL-2 ražošana pacientiem ar TKL ir saistīta arī ar iespējamā limfocītu T-helpera apakšpopulācijas limfotropā vīrusa sakāvi, kas padara tos spējīgus "nemirstīgai" augšanai.
Tādējādi ādas TCL veidošanās process sākas ar limfocītu aktivāciju dažādu kancerogēnu faktoru ietekmē un dominējošā T-šūnu klona parādīšanos. Kad tas parādās ādā, tās spēja veikt pretaudzēju kontroli lielā mērā atšķiras, kas nosaka procesa dinamiku pacientiem ar TCL - no plankumainiem aplikuma bojājumiem līdz lielu audzēju attīstībai un nāvei.
Kādi ir limfoproliferatīvo slimību veidi?
Eiropā visizplatītākā ir modificētā Ķīles klasifikācija, kurā ņemti vērā histoloģiskos un citoloģiskos parametri limfoproliferatīvās ādas slimībās. Atkarībā no ādas TCL attīstības dinamikas, audzēja šūnu diferenciācijas pakāpes un mikrovides tos iedala zemas (I), vidējas (II) un augstas (III) ļaundabīgo audzēju pakāpes audzējos.
Lai diagnosticētu ādas limfoproliferatīvās slimības, nepieciešams novērtēt izsitumu veidu (plankumi, plankumi, audzēji), to rašanās ātrumu, histoloģiskos, citoloģiskos, rentgena un tomogrāfiskos datus, klīnisko un bioķīmisko asins parametru rezultātus. , limfmezglu stāvoklis. Kaulu smadzeņu pētījumi ir attaisnojami tikai gadījumos, kad audzēja šūnas tiek konstatētas limfmezglos un/vai asinīs.
Limfoproliferatīvās slimības, to galvenie simptomi un īpašības. Akūtas leikēmijas un agrunolocitozes jēdziens, slimību būtība un to cēloņi. Limfoproliferatīvo slimību profilakse un ārstēšana. Zāles ārstēšanai un to efektivitāte.
Nosūtiet savu labo darbu zināšanu bāzē ir vienkārši. Izmantojiet zemāk esošo veidlapu
Studenti, maģistranti, jaunie zinātnieki, kuri izmanto zināšanu bāzi savās studijās un darbā, būs jums ļoti pateicīgi.
BALTKRIEVIJAS VALSTS MEDICĪNAS UNIVERSITĀTE
"Akūta leikēmija. Agrunolocitoze. Limfoproliferatīvās slimības »
MINSKA, 2008. gads
Akūta leikēmija
L iedalījums akūtā un hroniskā ir balstīts uz šūnu morfoloģiju.
Akūta leikēmija ir neviendabīga audzēju slimību grupa, kurā kaulu smadzenes ietekmē blasti - morfoloģiski nenobriedušas šūnas, savukārt asinsrades elementi kaulu smadzenēs tiek izspiesti un infiltrēti ar iekšējo orgānu blastiem.
Sastopamības biežums 5 uz 100 000 iedzīvotāju gadā
ETIOLOĢIJA
nezināms
Predisponējoši faktori:
Ш Jonizējošais starojums
III Citu audzēju ķīmijterapija un staru terapija
SH 20% OL smēķēšanas dēļ
Ш Iedzimtu slimību gadījumā paaugstinātas hromosomu nestabilitātes dēļ
SH T-šūnu vīruss - 1
Ш Apmaiņas (endogēnā) teorija: triptofāna un tirozīna metabolītu uzkrāšanās
PATOĢĒZE
1) OL ir hematopoētiskās šūnas ģenētiskā materiāla mutācijas sekas, kas, vairojoties, veido audzēja klonu
2) Audzēja šūnu izplatīšanās - metastāzes hematopoētiskajā sistēmā
3) Audzēja progresēšana - tās pamatā ir palielināta hromosomu variabilitāte un jaunu apakšklašu veidošanās, kuru dēļ mainās audzēja īpašības
KLASIFIKĀCIJA
FAB - klasifikācija
I — nelimfoblastiskas, mielogēnas (mieloīdās) leikēmijas, iedalītas 8 veidos
II - Limfoblastiska - 3 veidi
III - mielopoētiskā displāzija vai mielodisplastiskais sindroms - 4 veidi
OL citoķīmiskās īpašības
Galvenais ārstēšanas princips ir vispilnīgākā leikēmijas šūnu noņemšana visos posmos.
OL posmi:
sākotnējā
šūpoles
pilnīga remisija, nepilnīga
recidīvs
terminālis
Ir 2 šūnu populācijas – proliferējošās un neproliferējošās. Proliferācija ir cikla mitotiskā fāzē, to ietekmē polihemoterapija. Atsevišķas zāles iedarbojas noteiktās cikla fāzēs – 6-merkaptopurīns, ciklozāns; daži visam ciklam - vinkristīns, ciklofosfamīds, prednizons.
Terapijai jābūt šādai:
n intensīvs, garš
n apvienot ciklam raksturīgās un neciklospecifiskās zāles
Stabila un ilgstoša remisija ir 5 gadi vai vairāk
CALGB programma
I kurss - remisijas indukcija (4 nedēļas). Zāles ir norādītas uz mg / m 2
II kurss - agrīna intensifikācija (4 nedēļas)
III kurss – CNS profilakse un dzimumakta uzturošā terapija (12 nedēļas)
IV kurss - vēlīna intensifikācija (8 nedēļas)
V kurss - ilgstoša uzturošā terapija (līdz 24 mēnešiem no diagnozes brīža)
Ja ir recidīvs vai ugunsizturīgas formas, tiek izmantoti īpaši režīmi - 5 dienu RACOP, COAP, COMP un pēc tam galvenais režīms
Nelimfoblastiskās leikēmijas terapija - "7 + 3": citozīna-arabinozīds 7 dienas, pēc tam daunorubicīns 3 dienas
Zāles, ko lieto OL ārstēšanai:
1) Alkilējošie savienojumi, kas traucē NK - ciklofosfamīda sintēzi
2) Antimetabolīti — NA prekursori:
6-merkaptopurīns
Metotreksāts
3) Antimitotiskie līdzekļi - bloķē mitozi metafāzes stadijā, denaturējot tubulīnu
vinkristīns
4) Pretaudzēju a / b - antraciklīni, kavē DNS un RNS sintēzi
rubomicīns
5) Fermenti:
L-asparagināze iznīcina L-asparagīnu, jo sprādzieniem ir palielināta vajadzība pēc tā
Prednizolons 60 mg/m2
Uz polikemoterapijas fona seguma terapija ir obligāta:
SH A/B terapija
Ш Detoksikācijas terapija, ieskaitot hemosorbciju, plazmasferēzi
Ш Aizstājkomponentu terapija dziļai citopēnijai (Er-masas, trombocītu pārliešana)
SH Allopurinols 600 mg/m 2 masveida šūnu sabrukšanas dēļ
Ш Palieliniet šķidruma tilpumu līdz 3 litriem
Ш AA šķīdumi un tauku emulsijas
Ш Vīrusu un sēnīšu komplikāciju novēršana
Agranulocitoze
Agranulocitoze - leikocītu līmeņa pazemināšanās zem 1 * 10 9 / l vai granulocītu līmeņa pazemināšanās zem 0,75 * 10 9 / l.
Neitrofīli izdalās ar kaulu smadzenēm ar ātrumu aptuveni 7 miljoni / min, dzīvo 2-3 dienas, veido 60-70% no kopējā asins leikocītu skaita.
Absolūtais neitrofilu skaits- ANC \u003d leikocīti * (% stab + % segmentēti) * 0,01
Šo šūnu galvenā funkcija ir fagocitoze. Granulocītu satura samazināšanās asinīs un to fagocītu spēju pārkāpums izraisa paaugstinātu jutību pret infekcijām.
ETIOLOĢIJA UN PATOĢĒZE
1. Mielotoksiskā agranulocitoze- AI, citostatisko līdzekļu iedarbības rezultāts
Mehānismi: citolītisks, antimetabolisks
2. Imūnā agranulocitoze
Ķermenī esošo autoAT darbība (SLE gadījumā)
Antivielu darbība, kas sintezējas pēc zāļu lietošanas, kas izrādījās haptēni (diakarbs, amidopirīns, aspirīns, barbiturāti, fenacetīns, novokainamīds, levamizols, indometacīns)
KLĪNIKA
1) Infekcijas process ar smagu intoksikāciju
2) Drudzis ar drebuļiem
3) Inficētas čūlas uz gļotādām un ādas
4) pneimonija
5) Enteropātija (līdz nekrotiskai)
6) Limfoproliferatīvais sindroms: limfadenopātija, palielinātas aknas un liesa
ĀRSTĒŠANA
1. Hospitalizācija izolēti
2. Aseptisku apstākļu radīšana (gaisa UVR palātā, maskas, apavu pārvalki)
3. Pareizs uzturs - neizraisīt meteorismu, pāriet uz parenterālu barošanu atbilstoši indikācijām
4. Plaša spektra antibiotikas, pretsēnīšu līdzekļi, zarnu dekontaminācija
5. Plaša spektra antibiotikas, pretsēnīšu līdzekļi, zarnu dekontaminācija
6. GCS autoimūnā A prednizonā 100 mg/dienā. Ar haptēnu A kortikosteroīdi ir kontrindicēti
7. Pamatslimības ārstēšana
8. Kaulu smadzeņu transplantācija
9. Simptomātiski līdzekļi
pretsēnīšu līdzekļi - amfotericīns B 1 mg/kg IV 3 reizes nedēļā vai itrakonazols 5-10 mg/kg/dienā
Pretvīrusu terapija - aciklovīrs IV pa 5 mg/kg ik pēc 8 stundām; iekšķīgi - ganciklovirs 3 g / dienā; Ig IVIG 0,5 g/kg IV katru otro dienu 3 reizes nedēļā
1. Rekombinanto augšanas faktoru (G-CSF, GM-CSF) pielietošana
2. Lielu devu PCT ar metotreksātu izmanto leikovorīnu
3. Mutes dobuma apstrāde ar dezinfekcijas šķīdumiem (hlorheksidīns 0,05-0,12%, nātrija bikarbonāts)
LIMFOPROLIFERATĪVĀS SLIMĪBAS (HRONISKĀ LIMFOLEIKĒMIJA, PLAZMOCITOMA, LIMFOGRULEMATOZE)
Visām limfoproliferatīvajām slimībām ir kopīga izcelsme limfātiskās sistēmas (t.i., imūnsistēmas) šūnās. Tie ietver:
hroniska limfoleikoze (CLL);
plazmocitoma;
limfogranulomatoze (LGM).
Hroniska limfoleikoze
EPIDEMILOĢIJA
veido 30% no visām leikēmijām;
biežums: 3-35 uz 100 000;
20/100 000, kas vecāki par 60 gadiem;
M: W = 2: 1;
B-šūnu imūnfenotips konstatēts 96%, T-šūnu - 2,5%.
100% gadījumu tiek konstatētas hromosomu aberācijas, tai skaitā: 13. hromosomas garās rokas dzēšana (55%), 11. (18%). Ar T-šūnu leikēmiju - trisomija 7 hromosomu pāri.
Limfmezgli valrieksta lielumā, mīksta, mīklainas konsistences, nav kopā lodēti, kakls nogludināts.
KLA: leikocitoze, limfocitoze, ir prolimfocīti, paātrināta ESR, Gumprechta ēnas, eritrocītu un hemoglobīna līmeņa pazemināšanās, neitrofīli - tikai 1-2%.
Gumprechtas ēnas:
raksturīga CLL laboratorijas pazīme;
ir iznīcināti limfocītu kodoli;
to skaits nav procesa nopietnības rādītājs (t.i., artefakts);
Tie nav šķidrās asinīs, bet ir uz stikla (tie parādās, kad pār šo stiklu tiek izlaists cits stikls, kā rezultātā tiek iznīcināti limfocīti);
ir diagnostiska vērtība agrīnā stadijā.
Diferenciāldiagnoze:
tiek veikta ar citām limfoproliferatīvās grupas slimībām, piemēram, LGM, Valdenstrema makroglobulinēmiju (makroglobulīns ir IgM pentamers), plazmacitomu;
izlemiet, vai tā ir limfoma ar leikēmiju vai leikēmija ar skrīningu.
Komplikācijas:
paaugstināta uzņēmība pret infekcijām: imūnās atbildes defekts - T- un B-limfocītu mijiedarbības pārkāpums;
ar bronhu koka limfātisko folikulu hiperplāziju un pašu plaušu audu audzēja šūnu infiltrāciju - atelektāzi, traucētu ventilāciju un ar anaerobās floras pievienošanu - gangrēnu;
bieža flegmona (arī no injekcijām), nozokomiālo infekciju pievienošanās;
pleirīts (parapneimonisks, tuberkulozs);
tuberkuloze (imūndeficīta dēļ);
limfātiskā infiltrācija pleirā; ar limfas kanāla plīsumu - chilothorax;
ģeneralizēta herpes (līdz nāvei);
termināla stadijā - sarkomas augšana (hipertermija, diferenciācija no TB utt.);
ar nieru parenhīmas infiltrāciju - hroniska nieru mazspēja;
citolīzes sindroms: hemolīze un anēmija, retikulocīti asinīs, trombocitopēnija līdz hemorāģiskajam sindromam.
CLL ĀRSTĒŠANA
Sākotnējā citostatiskā terapija:
ar leikocitozi un mērenu LAP: leikerāns (hlorbutīns) 4-10 mg 1 reizi dienā; leikocitozes kontrole, l / y izmēri; uzturošā terapija: 4-8 mg katru otro dienu - klīniskās kompensācijas ierosināšana;
ar mērenu leikocitozi un smagu LAP: ciklofosfamīds (endoksāns) 200-400 mg iekšķīgi 1 reizi dienā; intermitējoša terapija 200-300-400 mg vienu reizi dienā 10 dienas iekšā (5 devas), pēc divu nedēļu pārtraukuma - atkārtojiet kursu.
CLL PCT programmas:
CHOP - ciklofosfamīds, vinkristīns, adriamicīns, prednizolons;
COP - ciklofosfamīds, vinkristīns, prednizons;
ATS - ciklofosfamīds, adriamicīns, prednizolons;
M 2 - ciklofosfamīds, karmustīns, vinkristīns, melfalāns, prednizons.
fludarabīns (FAMP);
jaunas zāles:
gemcitabīns;
kladribīns (2-hlordezoksiadenozīns);
mabthera (rituksimabs - himēriskas antivielas pret virsmas B-šūnu CD20);
antivielas Campath-1H (anti-CD52).
Paraproteinēmiskās leikēmijas ir audzēji, kas izdala monoklonālo Ig vai to fragmentus, kurus labi nosaka ar elektroforēzi.
Klīniskās pazīmes:
olbaltumvielu patoloģijas sindroms:
nefropātija (sekundārā amiloidoze);
polineiropātija;
asins hiperviskozitāte līdz komai;
hemostāzes pārkāpumi;
humorālās imunitātes pārkāpumi;
hiperurikēmiskais sindroms (piemēram, sekundāra podagra).
Imūnglobulīnu izdalošās limfomas:
multiplā mieloma;
vientuļa plazmocitoma;
makroglobulinēmija Valdenstrēms;
limfomas ar monoklonālu Ig sekrēciju;
smaga Ig slimība;
grūti klasificēt Ig izdalošos audzējus.
LITERATŪRA
1. Rainbow N.L. Iekšējās slimības Mn: VSH, 2007, 365s
2. Pirogovs K.T. Iekšējās slimības, M: EKSMO, 2005
3. Sirotko V.L., Viss par iekšējām slimībām: mācību rokasgrāmata maģistrantiem, Mn: VSH, 2008
...Līdzīgi dokumenti
Neirozes raksturojums: slimības cēloņi un galvenie simptomi, kurā nav organisku smadzeņu bojājumu. Sintētiskās narkotikas un ārstniecības augi, ko izmanto šīs garīgās slimības ārstēšanai. To uzņemšanas iezīmes.
kursa darbs, pievienots 23.02.2015
Mieloproliferatīvās slimības, to galvenie simptomi un īpašības. Plasmacitomas un limfogranulomatozes jēdziens un būtība. Slimību cēloņi un to profilakse. Lietoto zāļu ārstēšana un efektivitāte, to galvenie rādītāji.
abstrakts, pievienots 23.01.2009
Autoimūna tiroidīta kā vienas no biežākajām vairogdziedzera slimībām raksturojums. Slimības cēloņi, simptomi. Hipotireozes, tirotoksikozes pazīmes. Metodes un preparāti vairogdziedzera slimību ārstēšanai.
prezentācija, pievienota 16.06.2015
Leikēmijas ir audzēju slimības. To klasifikācija atkarībā no audzēja šūnu morfoloģiskajām īpašībām. Slimības cēloņi, tās klīniskā aina, gaitas stadijas. Analīzes un izmeklējumi, slimības ārstēšanas specifika.
prezentācija, pievienota 31.10.2012
Holecistīta attīstības jēdziens un galvenie cēloņi kā iekaisuma slimībažultspūslis, tā attīstības faktori un riska grupas. Šīs slimības akūtas un hroniskas gaitas simptomi, to ārstēšanas principi: homeopātiskā un klasiskā.
prezentācija, pievienota 26.10.2013
Mieloproliferatīvās slimības. Hroniska mieloleikēmija, vera policitēmija. Terapeitiskie pasākumi eritrēmijai. Hroniska limfoleikoze, plazmocitoma, limfogrulematoze. Gumprechtas ēnas. Diferenciāldiagnoze, etioloģija, klīnika un ārstēšana.
abstrakts, pievienots 10.01.2009
Akūtas leikēmijas, hroniskas limfoleikozes, hroniskas mieloleikozes, polycythemia vera definīcija, etioloģija un patoģenēze. Šīs slimību grupas klīniskā aina un diagnoze. Pacienta izmeklēšanas plāns. Leikēmijas ārstēšana, prognoze uz mūžu.
lekciju kurss, pievienots 07.03.2013
Mitohondriju slimību jēdziens kā heterogēna sistēmisku traucējumu grupa. Galvenās mitohondriju funkcijas. Mitohondriju slimību molekulāri ģenētiskā klasifikācija, to diagnostikas un ārstēšanas iezīmes. Zāles, kas veido ārstēšanas pamatu.
prezentācija, pievienota 30.03.2016
Akūta bronhīta, akūtu iekaisuma (pneimonija), destruktīvu (abscesu, gangrēna) plaušu slimību vieta starp elpceļu slimībām. Etioloģija un patoģenēze, plaušu slimību izraisītāji, to attīstības mehānisms, plaušu un ekstrapulmonālās komplikācijas.
prezentācija, pievienota 19.07.2016
Pustulozas ādas slimības (piodermatīts), ko izraisa zeltaini, virulenti citrondzelteni stafilokoki. Slimību ārējie un iekšējie faktori. Furunkuls (vāra), folikulīts, karbunkuls, hidradenīts. Slimību cēloņi un to ārstēšanas metodes.
ļaundabīgas limfomas. limfoproliferatīvie procesi. Hodžkina limfoma.
Neoplazmas, kas rodas no limfmezglu vai ekstranodālo limfoīdo audu elementiem, sauc par LIMFOMĀM. Limfomas tiek klasificētas kā hematopoētisko audu slimības - hemoblastozes, starp kurām izšķir leikēmijas (2/3), un sarkomas (hematosarkomas), kas veido 1/3. Leikēmiju raksturo primārs kaulu smadzeņu bojājums; hemoblastozēm ir raksturīgi, ka pat 1. stadijā ir raksturīga fokālu audzēju veidošanās no asinsrades audu elementiem bez kaulu smadzeņu (limfmezglu) bojājumiem. Starp tiem ir kopīgi kritēriji: leikēmiju var pavadīt limfmezglu, neiroapvalku, pleiras un tā tālāk bojājumi. Hemoblastozes, izplatoties, var iebrukt kaulu smadzenēs (leikolizācija) vai vispārināties (hematosarkomatoze). Hematosarkomu histoloģiskajā klasifikācijā ir:
A. LIMFOSARKOMAS (mezglainas, difūzas), sinonīms — ne-Hodžkina limfomas:
limfocītu,
limfoplazmacītisks,
prolimfocīts,
Limfoblastiska,
imūnblastisks,
Audzējs (limfoma) Burkitt.
B. Limfogranulomatoze (slimība, Hodžkina limfoma)
C. MIKOZE SĒNE
D.RETIKULOSARKOMA
E. PLAZMOCITOMA
F. NEKLASIFICĒTAS LIMFOMAS
G. CITA (MASTOCITOMA, EOZINOFILĀ GRANULOMA).
Hodžkina limfoma, limfogranulomatoze ir limfmezglu un limfātiskās sistēmas ļaundabīgs audzējs ar iespējamu citu orgānu turpmāku iesaistīšanos; audzēja patomorfoloģiskais substrāts ir lielas Berezovska-Šternberga, Pirogova-Rīda daudzkodolu šūnas. Pirmo reizi šo slimību 1832. gadā aprakstīja Tomass Hodžkins, un 1865. gadā šī nozoloģija tika izveidota. 1904. gadā VII Vācijas patologu kongresā tika ieviests termins LIMFOGRANULOMOZE, bet 2001. gadā jaunākajā PVO rekomendācijā termins Hodžkina limfoma tika ierosināts apzīmēt šo slimību. Līdz šim etioloģiskie faktori nav pilnībā noskaidroti. Ir vairākas teorijas par Hodžkina limfomu rašanos:
Infekciozi - ģimenēs ar LGM pacientiem saslimstība ir gandrīz 3 reizes lielāka. Ir aprakstīts vairāku klasesbiedru vienlaicīgas saslimšanas gadījums ar Hodžkina limfomu. Pēc dažu zinātnieku domām, šīs patoloģijas rašanos var izraisīt tuberkuloze, difterobaktērijas, sēnītes, stafilokoki, E. coli.
Vīruss -
Imūndeficīts - imūnās reaktivitātes samazināšanās, kā rezultātā rodas tendence uz vīrusu infekcijām, herpes, cietu audzēju attīstība, augsts prostaglandīnu līmenis, monocitoze (TB-limfocītu nomākšanas pazīme).
Audzējs - pakļaujas audzēja progresēšanas, viencentriskuma, metastāžu, netipisku šūnu izplatīšanās likumiem pa hematogēniem un limfogēniem ceļiem.
Šūnu imunitātes funkcijas pārkāpums izpaužas kā reakcijas samazināšanās pret mitogēniem kultūrā un aizkavētas paaugstinātas jutības reakcijas samazināšanās ar tuberkulīna un T atkarīgo antigēnu intradermālu ievadīšanu. Turklāt ar LGM ir T un B limfocītu mijiedarbības pārkāpums. T-limfocītu nomācošās funkcijas pārkāpums hipergammaglobulinēmijas izpausmē. Klīniski – tendence uz vīrusu infekcijām, tendence uz autoimūnām citopēnijām, rezistences pret bakteriālām infekcijām samazināšanās. Lielākā daļa zinātnieku ievēro Hodžkina limfomas unicentrisko izcelsmi.
Izplatība un epidemioloģija
Krievijā saslimstība ar Hodžkina limfomu bija 2,3 uz 100 tūkstošiem iedzīvotāju, ASV - 2,8 uz 100 tūkstošiem.Vīrieši slimo vairākas reizes biežāk nekā sievietes. Saslimstība notiek jebkurā vecumā, bet līknei ir divi maksimumi - 15-35 gadi, bet otrais pēc 50 gadiem. Nesen tiek apšaubīta otrā pīķa klātbūtne. Jauno pacientu vidū dominē sievietes, vecāka gadagājuma grupā – vīrieši. Jauno pacientu vidū dominē sievietes. Vecāko grupu pacientu vidū ir vīrieši.
Limfoproliferatīvo procesu etioloģiskie faktori.
Daudzos pētījumos ir konstatēta saikne starp Epšteina-Barra vīrusa infekciju un limfomas sastopamību. Turklāt inficētiem pacientiem risks saslimt ar Hodžkina limfomu ir 3 reizes lielāks nekā neinficētiem pacientiem. Pastāv arī augsts Hodžkina limfomas risks pacientiem ar infekciozu mononukleozi. Tomēr Hodžkina limfomas patoģenēze joprojām nav skaidra. Pašlaik starp daudzajām Berezovska-Šternberga šūnu izcelsmes teorijām izšķir vācu zinātnieku hipotēzi: lielas mononukleārās šūnas (Hodžkins) un Berezovskis-Rīds-Šternbergs ir nobriedušu B šūnu monoklonālas proliferācijas rezultāts, kas nāk no germinālā centra. limfmezglu folikula. Šīs šūnas, izvairoties no apoptozes, ieguva nekontrolētas proliferācijas iespēju. Tajā pašā laikā apoptozes bloks ir galvenā saikne šīs patoloģijas patoģenēzē. Imunoloģiskie marķieri ar diferenciāldiagnostisko vērtību ir CD15 un CD30 antigēni, parasti bez CD45 un retas CD 20 ekspresijas ar Berezovska-Rīda-Šternberga šūnām. Hodžkina limfomu pavada T-šūnu imunitātes nomākums. Pacienti ir uzņēmīgi pret dažādām vīrusu infekcijām, galvenokārt herpetiskām (H. Zoster). Retos gadījumos Hodžkina limfoma tiek kombinēta ar tuberkulozi.
Patoloģiskās īpašības.
Hodžkina limfomas diagnoze tiek noteikta tikai histoloģiski un tiek uzskatīta par ticamu tikai tad, ja tiek atrastas specifiskas divkodolu vai daudzkodolu Berezovska-Rīda-Sternberga šūnas. Citoloģiskā izmeklēšana ir obligāta diagnozes pirmajā posmā, lai izstrādātu izmeklēšanas plānu. Tomēr ar šo metodi ne vienmēr ir iespējams noteikt Hodžkina limfomas variantu un veikt diferenciāldiagnozi ar dažāda veida lielām ne-Hodžkina limfomām. Lai veiktu adekvātu histoloģisku izmeklēšanu, limfmezgls ir pilnībā jāizņem, jo pilnīga diagnoze ir iespējama tikai pārbaudot visa mezgla struktūru. Tas ir saistīts ar faktu, ka situācijas nav nekas neparasts, kad audzējs ietekmē tikai daļu noņemtā limfmezgla. Sarežģītās diferenciāldiagnostikas situācijās ir nepieciešams veikt audzēja audu imūnmorfoloģisko izpēti.
Saskaņā ar mūsdienu starptautisko morfoloģisko klasifikāciju tiek izdalīti 4 klasiskās Hodžkina limfomas histoloģiskie varianti:
1) ar mezglainu (mezglu) sklerozi
2) jauktā šūna;
3) ar limfocītiem bagātā klasiskā Hodžkina limfoma (Lymphocyte-rich klasiskā Hodžkina limfoma);
4) ar difūzās fibrozes vai tā sauktā retikulārā tipa limfoīdo noplicināšanos (vai nomākšanu).
Limfohistiocītisks. Smaga histiocītu limfoīdā proliferācija. Eozinofilu un plazmas šūnu difūza-fokāla un nevienmērīga uzkrāšanās. Ir maz Berezovska - Rīda - Šternberga raksturīgo šūnu. Nav nekrozes perēkļu.
Jaukts variants. Limfmezgla raibs šūnu sastāvs ar lielu skaitu Berezovska-Red-Sternberg šūnu ar nekrozes perēkļiem. Biežāk tiek ietekmēts viss mezgls, bet ir iespējams mezgla fokālais bojājums.
mezglu skleroze. Rupju šķiedru saistaudu slāņu attīstība, sadalot limfmezglu atsevišķos mezglos, kuros ir tipiskas Berezovska-Rīda-Šternberga šūnas, nekrozes perēkļi uz neitrofilu un histiocītu uzkrāšanās fona.
Limfoīdu samazināšanās. Haotiska saistaudu attīstība, ievērojams šūnu skaita samazinājums, netipisku histiocītu un Berezovska-Rīda-Šternberga šūnu proliferācija.
Klasiskās Hodžkina limfomas īpatnību nosaka tās morfoloģiskais substrāts: polimorfocelulāras granulomas klātbūtne, ko veido limfocīti, neitrofīli, eozinofīli, histiocīti, plazmas šūnas, starp kurām ir lielas viena kodola Hodžkina šūnas un milzu divkodolu vai daudzkodolu Berezovska-Reds. Sternberg šūnas atrodas reti. Dažādās pakāpēs var izteikties fibrozes parādības, ir nekrozes perēkļi. Normālais struktūras modelis skartajā limfmezglā tiek pakāpeniski izdzēsts. No dažādiem granulomas elementiem tikai Hodžkina un Berezovska-Rīda-Šternberga šūnas ir audzēja šūnas (to aneuploiditāte un klonalitāte ir pierādīta). Visi pārējie šūnu elementi - limfocīti, histiocīti, plazmas šūnas, eozinofīli utt. - ir reaktīvs komponents un nav audzējs; tiek uzskatīts, ka tie atspoguļo limfoīdo audu reakciju uz Berezovska-Rīda-Šternberga šūnu proliferāciju.
Variants ar mezglaino sklerozi biežāk sastopams gados jauniem pacientiem, starp kuriem dominē sievietes. Šajā variantā ir vairāk sākuma stadiju ar limfmezglu iesaistīšanos tikai virs diafragmas. Audzēja audu arhitektonikas īpatnība ir saistīta ar kolagēna pavedienu klātbūtni, kas sadala mezglu noapaļotās zonās - mezgliņos.
Jaukto šūnu variants pārsvarā sastopams vecāka vecuma grupas pacientiem. Šim variantam ir klasisks morfoloģisks attēls, kad limfmezglu struktūras modelis ir izdzēsts, un Hodžkina šūnas un Berezovska-Rīda-Šternberga audzēja šūnas reti tiek izkaisītas starp limfocītiem, eozinofiliem, histiocītiem utt.
Ar limfocītiem bagāta klasiskā Hodžkina limfoma ir reta. Limfmezgla histoloģiskā izmeklēšana liecina, ka starp reaktīvajām šūnām dominē mazie limfocīti, savukārt Hodžkina un Berezovska-Rīda-Šternberga šūnu ir maz. Šim Hodžkina limfomas variantam ir vislabvēlīgākā gaita - pacientu 15 gadu dzīvildze sasniedz 90%.
Limfoīdo izsīkuma variants ir ļoti reti sastopams. Starp difūzo fibrozi tiek konstatēti nelieli dažādu šūnu elementu uzkrājumi, dominē Berezovska-Rīda-Šternberga audzēja šūnas. Variantam raksturīga slikta prognoze.
Visbiežāk un aptuveni vienādās proporcijās ir varianti ar mezglaino sklerozi un jauktu šūnu (30-45% katrā) un tikpat reti (līdz 10%) - limfocītiem bagāti un ar limfoīdo izsīkumu.
Hodžkina limfomas diferenciāldiagnoze tiek veikta ar lielu šūnu limfomām, gan B-, gan T-šūnu rakstura: arī ar nespecifisku limfadenītu. Šūnas, kas atgādina Hodžkina šūnas un Pirogova-Langhans tipa šūnas (lieli, daudzkodolu šūnu elementi), var rasties tuberkulozes un aktinomikozes gadījumā un radīt diagnostikas grūtības. Tomēr daudzkodolu Berezovska-Rīda-Šternberga šūnu trūkums parasti ļauj veikt diferenciāldiagnozi pat gaismas mikroskopijas līmenī.
klīniskā aina.
Ir 3 plūsmas formas.
Akūts - raksturojas ar strauju sākšanos, augstu ķermeņa temperatūru, adinamiju, stipru svīšanu, aknu, plaušu u.c. bojājumiem.
Subakūts - ir nekontrolējama procesa progresēšana, anēmija, izsīkums.
Primārās lokalizācijas noteikšana šajās formās nav iespējama.
Hronisks - (92% gadījumu) vidējais diagnozes ilgums ir aptuveni 3 mēneši no klīnisko izpausmju brīža (tuberkuloze, reimatisms, limfadenīts, mononukleoze, infekcijas, sifiliss).
Vispārēji simptomi - izpaužas ar ķermeņa temperatūras paaugstināšanos līdz subfebrīlam, drudžainiem skaitļiem, kas ilgst līdz 2-3 dienām ar labu toleranci, remitējošu raksturu, vājumu. Pastiprināta svīšana (biežāk naktī), ādas nieze - ierobežota vai vispārināta. Svara zudums - 10% vai vairāk no ķermeņa svara, sāpes locītavās, muskuļos, galvassāpes.
Pacientu izmeklēšana ar
Ārstēšana pacientiem ar
Ārstēšanas rezultāti un piecu gadu dzīvildze