Солна киселина- химическо вещество, което се представя под формата на взаимодействие на вода и хлороводород. В чистата си форма киселината няма цвят. Техническата форма на киселината има жълтеникав оттенък, тъй като съдържа желязо, хлор и някои други елементи. Солната киселина се използва в много области на човешкия живот. Областите на приложение на солната киселина са много разнообразни. Нека ги разгледаме по-нататък.
Използването на солна киселина в промишлеността
Например хранително-вкусовата промишленост използва киселина като хранителна добавка E507. Тази добавка се използва в процеса на производство на водка, както и различни сиропи. Използването на солна киселина в хранително-вкусовата промишленост играе главно ролята на регулатор на киселинното състояние на продуктите. В металургията техническата солна киселина е популярна. Използва се за почистване на метал преди запояване или калайдисване. Ецването и декапирането при електроформоването не е пълно без участието на солна киселина. Създава активна среда за горепосочените процеси.
За да не създава ненужни проблеми използването на солна киселина в промишлеността, е необходимо да се подходи отговорно към избора на нейния тип и концентрация.
Използването на солна киселина в ежедневието
Вероятно не сте се замисляли за състава на почистващите продукти, които използвате ежедневно. Много от тях съдържат солна киселина. Използване в ежедневието, за тоалетна: използваме продукти, които са силно киселинни, поради което трябва да се използват само с гумени ръкавици. Това ще предпази ръцете ви от раздразнение.
Домакините използват разтвор на солна киселина у дома. Използването му като средство за отстраняване на петна помага да се отървете от ръжда или мастило върху дрехите. Солната киселина трябва да се съхранява в стъклени съдове на място, недостъпно за малки деца. Ако солната киселина попадне върху кожата или лигавиците, е необходимо незабавно да измиете засегнатата област с течаща вода. Използването на солна киселина у дома трябва да се извършва при спазване на правилата за безопасност. В допълнение към способността да премахва трудни петна от дрехите, солната киселина се използва за борба с котления камък. За да не се влоши ситуацията при почистване на мръсни съдове, се препоръчва използването на определена концентрация на киселина. В тези случаи се използва инхибирана солна киселина, чието използване ви позволява да поддържате целостта на съдовете, изработени от крехки материали.
За да поддържате дома и дрехите си чисти, трябва да имате солна киселина у дома. Употребата в ежедневието трябва да бъде изключително внимателна, за да не навредите на себе си и на нещата, с които взаимодействате.
Използването на солна киселина в медицината
Солната киселина е един от компонентите на човешкия стомашен сок. Следователно, в случай на намаляване на концентрацията му, се предписват лекарства на базата на солна киселина. Използването на солна киселина в медицината играе специална роля за здравето на човек със заболявания на храносмилателния тракт. Поради наличието на известно количество солна киселина в стомашния сок, храната се усвоява и микроорганизмите, попаднали в стомаха, умират.
Солната киселина се използва и за лечение на специфични кожни заболявания (брадавици). Употребата в народната медицина стана широко разпространена: за подобряване на храносмилането с ниска киселинност на стомашния сок е необходимо да се приемат препарати от солна киселина преди хранене. Използването на солна киселина (соли) помага в борбата с храносмилателните разстройства.
Използването на солна киселина в строителството
Солната киселина се използва за подобряване на качеството на много строителни процеси. Например, добавянето на солна киселина към бетонова смес повишава нейната устойчивост на замръзване. Освен това сместа се втвърдява по-бързо и зидарията става по-устойчива на влага. Известно е също използването на солна киселина в строителството като почистващо средство за варовик. Червената тухла се почиства от мръсотия и следи от строителни материали с 10% разтвор на солна киселина. Важно е да запомните, че не всички видове тухли се влияят от солна киселина, без да се уврежда структурата на строителния продукт. Следователно трябва да използвате само десет процента солна киселина. Химическият разтвор на солна киселина значително спестява финанси, тъй като други почистващи препарати могат да струват десет пъти повече.
Ниската цена не прави използването на солна киселина по-малко ефективно. Киселината се използва в много отрасли: от медицината до строителството. Но, както всички други киселини, солната киселина има способността да дразни кожата и високите концентрации могат да доведат до изгаряния.
Можете да закупите солна киселина онлайн, като кликнете върху връзката
Киселините - като химически съединения са сравнително широко използвани в ежедневието. Според агрегатното състояние киселините биват кристални вещества, течни и газообразни. Всички киселини имат кисел вкус, всъщност именно заради киселия вкус се наричат киселини. киселините имат различни Химични свойства: Взаимодействам с основи, основни оксиди, имам разрушителен ефект върху много метали, увреждам тялото, когато попадна на повърхността или вътре. Сярна, солна, оцетна киселиниможе да причини тежки изгаряния, да разруши тъканите. Ето защо при работа с киселини трябва да се вземат предпазни мерки. Ако киселината попадне върху дрехите или върху повърхността на тялото, тогава тя трябва да се измие много бързо с много течаща вода или да се неутрализира с разтвор на амоняк (амоняк). И ако киселината е попаднала върху дървена, метална или друга повърхност, тогава тя се неутрализира с вар, креда или сода. Киселините трябва да се съхраняват в добре затворен съд на място, недостъпно за деца, като върху контейнера трябва да има етикет с името на киселината. Къде, за какви цели се използват киселините в бита?
Солната киселина разтваря добре метали, включително цинк, калай, желязо, но не взаимодейства със злато, сребро и мед. Солната киселина може да се смесва с вода във всяко съотношение. Използва се за почистване на емайлирани и фаянсови мивки, тоалетни чинии, умивалници от варовик. Може да се използва за почистване на тъкани от петна от ръжда, мастило (приготвя се разтвор на слаба киселина). Солната киселина разрушава тъкани от лен, памук, коприна. Причинява химически изгаряния при контакт с кожата
Сярната киселина е по-силна киселина от солната киселина, концентрирана карбонизира захар, дърво, памук, вълна и причинява много дълбоки изгаряния на кожата. При приготвянето на разтвор на сярна киселина трябва да се спазва следното правило: Киселината се излива във вода на тънка струйка по стената на стъклен съд, но не и обратно. Сярната киселина, поради способността си да абсорбира големи количества вода, се използва за отводняване на прозорци през зимата, след поставяне на концентриран разтвор между рамките сярна киселинав чаша, запълваща 1/5 от обема.Сярна киселина се използва и за приготвяне на акумулаторна киселина.
Азотната киселина в ежедневието се използва само под формата на разредени разтвори за почистващи продукти, предимно от благородни метали.
Оцетна киселинаизползва се или под формата на трапезен оцет с концентрация на киселина до 9%, или под формата на 80% есенция.
Разредената киселина не засяга метали, тъкани от растителен и животински произход, човешки и животински кожи. Оцетът се използва като подправка за ястия за намаляване на твърдостта на водата, премахване на петна от плодове от тъканите.
Оксалова киселинаизползва се за премахване на петна от мастило, боя, ръжда. Кристалната киселина може да причини изгаряния на лигавицата на устата, хранопровода и стомаха. Това е токсично вещество.
Мравчена киселинаподобен на оцета, но отровен, причиняващ много тежки изгаряния и кожни раздразнения.
Лимонена киселина-кристално безцветно вещество, силно разтворимо във вода и етилов алкохол. Използва се за премахване на всякакви петна: от вино, различни горски плодове, бои, ръжда, мастило.
Борна киселина - безцветно кристално вещество, в медицината (борен мехлем), като микротор и средство за борба с хлебарки и домашни мравки.
Има два вида киселини: органични и неорганични, като разликите между тях са, че първите винаги съдържат въглеродни молекули.
Органичните киселини влизат в тялото с плодове, зеленчуци, плодове и млечни продукти. Някои киселини са витамини, като витамин С - аскорбинова киселина.
Неорганичните киселини също могат да идват от храната, но могат и да се произвеждат от тялото самостоятелно. Солната киселина присъства в стомашния сок, под действието му бактериите, които влизат в стомаха с храна, умират. Сярноводородната киселина се съдържа в минералната вода.
Приложение на киселини
Сярната киселина е на първо място сред киселините. Използва се в големи количества за производство на торове, химически влакна, пластмаси, лекарства. Той е пълен с киселинни батерии, използвани за извличане на метали от руда. В петролната промишленост се използва за пречистване на петролни продукти.
Оцетната киселина има бактерициден ефект, нейният разтвор се използва при консервирането на храни, за производството на лекарства, при производството на ацетон, при боядисване и печатане.
Солната киселина се използва за обработка на сондажни зони в нефтената промишленост.
Азотната киселина играе важна роля в производството на торове, лакове, багрила, пластмаси, експлозиви и лекарства.
Фосфорната киселина се включва в съставите за обезмасляване на метални материали преди нанасянето на защитни състави върху тях. Включва се в агенти за преобразуване на ръжда преди нанасяне на боя и се използва като защита от корозия на тръбопроводи.
Лимонената киселина се използва при създаването на козметика, като разредител и консервант. Поради своите избелващи, почистващи и стягащи свойства, той се използва в почистващи кремове, изплаквания за коса, кремове против пигментация и бои за коса.
Ацетилсалициловата киселина е ефективна за профилактика на заболявания на сърдечно-съдовата система, намалява образуването на кръвни съсиреци, има аналгетичен ефект, поради което се използва интензивно в медицината.
Борната киселина се използва и в медицината заради нейните антисептични свойства. Използва се при педикулоза (въшки), при лечение на отит, конюнктивит, възпаление на кожата.
Стеариновата киселина се използва в производството на сапун. Добавянето му към сапуна гарантира, че продуктът оставя кожата гладка, мека и има успокояващ ефект.
КУРСОВА РАБОТА
СОЛНА КИСЕЛИНА. СТОКОВ
Въведение
1. Приложение на солната киселина в областта на производството или потреблението
3. Технология за производство на солна киселина и нейното предпроектно проучване
4. Стандарти за солна киселина, нормализирани показатели за качество в съответствие с изискванията на стандартите
5. Контрол на качеството на стоките. Стандарти за правилата за приемане, изпитване, съхранение и експлоатация на стоки
5.2.1 Маркиране
5.2.2 Опаковка
5.2.3 Изисквания за безопасност
5.2.4 Приемане
5.2.5 Методи за анализ
Заключение
Списък на използваните източници
Въведение
Обемът на производството в предприятията от химическата и нефтохимическата промишленост в Беларус през януари-юли тази година се е увеличил в сравними цени с 5,4% в сравнение със съответния период на миналата година и възлиза на около Br3,7 трилиона.
За успешна работа в тази област е необходимо постоянно да се следи качеството на продуктите, както и да се подобряват техните качествени характеристики.
Солната киселина е най-важният продукт на химическата промишленост и е безцветна течност с остра миризма на хлороводород.
цел срочна писмена работае анализ на потребителските свойства и приложенията на солната киселина.
Има редица задачи за изпълнение по време на работата.
Обмислете използването на солна киселина в областта на производството и потреблението;
Определете класификационните характеристики на солната киселина;
Анализира технологията на производство на солна киселина;
Помислете за качествени показатели;
Да се идентифицират стандарти за правилата за приемане, изпитване, съхранение на солна киселина.
Обект на курсовата работа е солната киселина.
По време на работата използвахме учебни ръководствапо стокознанието на нехранителни продукти на автори като Epifantseva V.V., Sytsko V.E., Karolkova R.V. и други автори, както и учебници по химическата индустрия, както и медиите.
Курсовата работа се състои от пет глави, заключение-заключение, както и списък на използваните източници.
1. Приложение на солната киселина в областта на производството или потреблението
Превозът се извършва с железопътни цистерни, в полиетиленови варели с вместимост 20-45 3, в полиетиленови бидони с вместимост 20, 40 и 50 dm3.
Между другото, известен фактче солната киселина се намира в стомашния сок (около 0,3%) и играе важна роля, тъй като подпомага смилането на храната и убива различни патогенни бактерии (холера, коремен тиф и др.). Ако последните попаднат в стомаха заедно с голямо количество вода, тогава поради разреждането на разтвора на HCl те оцеляват и причиняват заболяване в тялото. Ето защо по време на епидемии суровата вода е особено опасна. С повишаване на концентрацията на HCl в стомаха се усеща "киселини", което се елиминира чрез поглъщане на малко количество NaHCO 3 или MgO. Напротив, при недостатъчна киселинност на стомашния сок се предписва солна киселина за перорално приложение (5-15 капки 8,3% HCl на 1/2 чаша вода преди или по време на хранене).
производство солна киселинасинтетичен е овладян през 1962 г. През периода на експлоатация са извършени ремонти, подобрено е технологичното оборудване. Високото качество на суровините позволява да се получи висококачествена киселина. солна киселина същоизползва се в производството на пластмаси, пестициди, междинни продукти и багрила за почистване на повърхността на метали от оксиди, карбонати, в електрическата и текстилната промишленост.
Инхибирана солна киселинаСтепен А - използва се за киселинна обработка на кладенци в петролната промишленост, за да се подобри връзката на кладенците с пласта (за разширяване и почистване на пори и пукнатини, премахване на съпротивлението на филтриране на резервоар, съставен от карбонатни скали-доломити и варовици, или замърсени с карбонатни отлагания).
солна киселинаклас Б - използва се за ецване на черни и някои цветни метали и изделия от тях, за химическо почистване на котли и апарати от неорганични отлагания.
Солната киселина се използва за получаване на хлориди на Zn, Ba. Mg, Ca, Fe, A1 и др., за декапиране при запояване и калайдисване и цветната металургия (извличане на Pt, An), при хидролиза на дървесина, при производство на багрила, за хидрохлориране на органични съединения, и т.н.
2. Класификационни характеристики на солната киселина
Солната киселина се произвежда в две степени: А и Б.
Според физичните и химичните показатели техническата синтетична солна киселина трябва да отговаря на стандартите, посочени в таблица 2. 1.
Таблица 2.1Норми за солна киселина.
| Име на държавата | Норма за марката | Методи за анализ | ||
| AOCP 21 2211 0100 | BOKP21 2211 0200 | |||
| 1. Външен вид | бистра жълта течност | Съгласно 6.4 | ||
| 35 | 33 | 31,5 | Съгласно 6.5 | |
| 0,001 | 0,002 | 0,015 | Съгласно 6.6 | |
| 0,010 | 0,015 | 0,100 | Съгласно 6.7 | |
| 0,002 | 0,002 | 0,008 | Съгласно 6.8 | |
| 0,0001 | 0,0001 | 0,0002 | Съгласно 6.9 | |
| 0,0003 | 0,0004 | 0,0005 | Към 6.10 | |
Масовата част на живака се нормализира в киселината, получена от водород и хлор чрез електролиза на живак. Разрешено е хранително-вкусовата промишленост, съгласувано с потребителя, да произвежда киселина с масова част на хлороводорода не повече от 26%.
В киселината, доставена за ецване на метали, масовата част на желязото и остатъка след калциниране не е стандартизирана.
По споразумение с потребителя се допуска масова част от хлороводород от най-малко 30% в двете степени на киселина.
Солната киселина се произвежда в следните степени: техническа (27,5% НС1); синтетичен (31% НС1), инхибиторен (20% НС1) и реактивен (35-38% НС1, плътност при 20°C е 1,17-1,19 g/cm3).
3. Технология за производство на солна киселина и нейното предпроектно проучване
сулфат;
Синтетичен
Все пак трябва да се отбележи, че първите два метода губят индустриалното си значение.
Производството на солна киселина (реактивна, сулфатно произведена, синтетична отработена газова) се състои в производството на HCI, последвано от абсорбирането му с вода. В зависимост от начина на отвеждане на топлината на поглъщане, която достига 72,8 kJ/mol, процесите се разделят на изотермични (при постоянна температура), адиабатични (без топлообмен с заобикаляща среда) и комбинирани.
1. Сулфатният метод се основава на взаимодействието на натриев хлорид NaCl с концентрирана сярна киселина H2SO4 при 500-550*C. Реакционните газове от муфелни пещи съдържат 50-65% хлороводород, а газовете от реактори с кипящ слой до 5% HCI. Понастоящем се предлага да се замени сярната киселина със смес от SO2 и O2, като се използва Fe2O3 като катализатор и провеждане на процеса при температура 540*.
2. Директният синтез на солна киселина се основава на верижна реакция на горене:
Р2-CI2+2HCI +184.7 kJ (3.1)
Реакцията се инициира от светлина, влага, твърди порести вещества (въглен, пореста платина) и някои минерални вещества (кварц, глина). Синтезът в горивните камери се извършва с излишък от 5-10% H2. Камерите са изработени от стомана, графит, кварц, огнеупорни тухли. Най-модерният материал, който предотвратява замърсяването на продукта, е графитът, импрегниран с фенолформалдехидни смоли. За да се предотврати експлозивният характер на горенето, реагентите се смесват директно в пламъка на горелката. В горната зона на горивните камери са монтирани топлообменници за охлаждане на реакционните газове до 150-160*C. Капацитетът на съвременните графитни пещи достига 65 тона/ден (по отношение на солна киселина, съдържаща 35% HCI). В случай на дефицит на водород се използват различни модификации на процеса. Например, смес от CI2 с водна пара преминава през слой от порести горещи въглища:
CO+H2O+CI2=2HCI+CO2 (3.2)
Повече от 90% от солната киселина в ОНД понастоящем се получава от отделен газ хлороводород HCI, който се образува по време на хлориране и дехидрохлориране на органични съединения, пиролиза на органохлорни отпадъци, метални хлориди, производство на поташ нехлорирани торове и др. .
Отработените газове съдържат различни количества хлороводород, инертни примеси (N2H2CH4), органични вещества, слабо разтворими във вода (хлоробензен, хлорометани), водоразтворими вещества (оцетна киселина, хлорал), киселинни примеси и вода.
HCI в отработените газове. Най-обещаващите са абсорбери, които ви позволяват да извличате от оригиналния отработен газ от 65-85% HCI.
В индустрията адиабатните абсорбционни схеми се използват най-широко за производството на солна киселина. Отработените газове се въвеждат в долната част на абсорбера, а вода (или разредена солна киселина) се въвежда в противоток в горната част.
Солната киселина се нагрява до точка на кипене от температурата на разтваряне на HCI. Зависимостта на промяната в температурата на абсорбция и концентрацията на HCI е показана на фиг. 3.1
Ориз . 3.1 Температурно разпределение (крива 1) и концентрация (крива 2) на HCI на височината на адиабатния абсорбер
Температурата на абсорбция се определя от точката на кипене на киселината със съответната концентрация, максималната точка на кипене на азеотропната смес е около 110 *.
Типична диаграма на адиабатната абсорбция на HCI от отделящи се газове от хлориране е показана на фигура 4.2. Хлороводородът се абсорбира в абсорбера 1, а остатъците от слабо водоразтворими органични вещества се отделят от водата след кондензация в апарата 2, пречистват се в опашната колона 4 и сепараторите 3.5 и се получава търговска солна киселина.
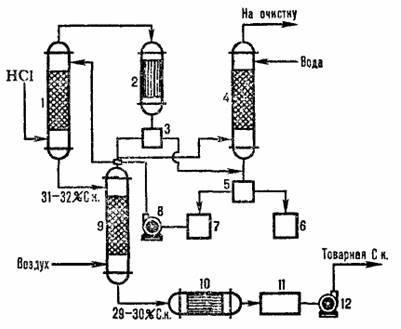
1 - абиабатичен абсорбатор; 2 - кондензатор; 3, 5 - сепаратори; 4 – опашна колона; 6 – колектор на органична фаза; колектор на водна фаза; 8.12 - помпи; 9 – стрипинг колона; 10 - топлообменник, 11 - търговски киселинен колектор.
Фиг.3.2Схема на типична адиабатна абсорбция на солна киселина от отпадъчни газове
Производството на солна киселина от отработени газове, използвайки комбинирана абсорбционна схема, е представено под формата на типична схема на фиг. 3.3.
В адиабатната абсорбционна колона се получава солна киселина с намалена концентрация, но свободна от органични примеси. Киселина с повишена концентрация на НС1 се получава в изотермична абсорбционна колона при понижена температура. Степента на извличане на HCI от отпадъчни газове, когато се използват разредени киселини като абсорбенти, е 90-95%. Когато се използва чиста вода като абсорбент, възстановяването е почти пълно.
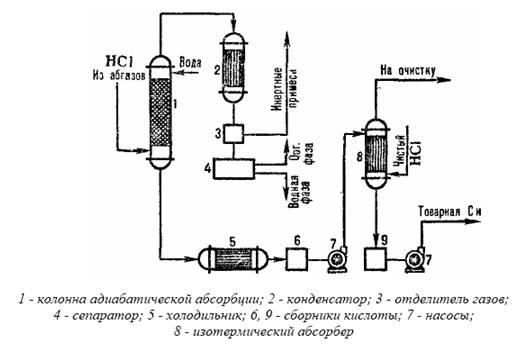
Фиг.3.3Схема на типична комбинирана абсорбция на солна киселина от отпадъчни газове
Хлороводородът се използва за производството на хлорорганични продукти чрез хидрохлориране на органични съединения, като етилен, ацетилен.
4. Стандарти за солна киселина, нормализирани показатели за качество в съответствие с изискванията на стандартите
GOST е държавен стандарт за качество.
Солната киселина трябва да отговаря на следните GOST:
ГОСТ. 14261-77. Солна киселина със специална чистота. Спецификации. Дата на въвеждане 01-07-1978. Дата на промяна - 01.12.1987 г.
Този стандарт се прилага за солна киселина с висока чистота, която е безцветна прозрачна течност, димяща във въздуха.
ГОСТ 30553-98.Солна киселина техническа. Определяне на общата киселинност чрез титриметричен метод. MKS код 71.060.30 Дата на въвеждане 01.01.2001г. Установява титриметричен метод за определяне на общата киселинност (съдържание на хлороводород) в търговската солна киселина.
ГОСТ 30554-98Солна киселина техническа. Определяне на сулфатна пепел чрез гравиметричен метод. Дата на въвеждане 01-07-2003.
ГОСТ 30582-98.Солна киселина техническа. Определяне съдържанието на желязо чрез спектрометричен метод с 2,2"-бипиридил. Дата на въвеждане 01-07-2003.
ГОСТ 30621-98.Солна киселина техническа. Определяне на съдържанието на арсен чрез фотометричен метод с използване на сребърен диетилдитиокарбамат. Дата на въвеждане 01-07-2003.
ГОСТ 3118-77Реактиви. Солна киселина. Спецификации. Стандартът се прилага за солна киселина (воден разтвор на хлороводород), която е безцветна течност с остра миризма, димяща във въздуха; смесва се с вода, бензен и етер.
ГОСТ 857-95.Киселина солна синтетична техническа. Спецификации. Стандартът се прилага за техническа синтетична солна киселина, получена чрез абсорбция на хлороводород от вода, която се образува при взаимодействието на изпарения, електролитен хлор, отпадъчни газове от втечняването на хлор с водород.
5. Контрол на качеството на стоките. Стандарти за правилата за приемане, изпитване, съхранение и експлоатация на стоки
5.1 Теоретични основи на стандартизацията на качеството и продуктите
СТАНДАРТ (от английски standard - норма, образец), в широкия смисъл на думата - образец, стандарт, модел, взет като изходен за сравнение на други подобни обекти с тях. Стандартът като регулаторен и технически документ установява набор от норми, правила, изисквания към обекта на стандартизация. Стандартът може да бъде разработен както за материални обекти (продукти, стандарти, проби от вещества), така и за норми, правила, изисквания в различни области.
ТЕХНИЧЕСКИ УСЛОВИЯ (TS) е регулаторен и технически документ, който установява набор от изисквания за продукти от определени видове, марки, артикули. Разработен въз основа на съответните стандарти.
ТЕХНОЛОГИЧНАТА КАРТА е форма на технологична документация, която отразява целия процес на обработка на продукта, посочва операциите и техните компоненти, материали, производствено оборудване и технологични режими, времето, необходимо за производство на продукта, квалификацията на работниците и др.
МАРШРУТЕН ЛИСТ (карта) е документ, който записва производството на продукти и движението на партида от обработени части през операции.
ТЕХНИЧЕСКИ РЕГЛАМЕНТ - документ, съдържащ задължителни изисквания на обществото, одобрен от компетентен държавен орган. За дървения материал техническите регламенти включват документи, съдържащи изисквания за радиационна и фитосанитарна безопасност, както и безопасността на транспортиране и преработка.
Качеството на продукт (работа, услуга) е набор от характеристики на продукт (работа, услуга), свързани с неговата способност да задоволи установените и (или) очакваните нужди на потребителя (безопасност, функционална пригодност, експлоатационни характеристики, надеждност). , икономически, информационни и естетически изисквания и др.).
Комплексът от прилагани мерки в областта на качеството включва разработването и производството на нови продукти, въвеждането на ресурсоспестяващи технологии, както и реконструкцията и техническото преоборудване на производствените мощности.
Сертификат за качество - писмен документ или марка на признат рафинер, който посочва името на благородния метал, неговата проба, сериен номер и името на фирмата производител
Техническият кодекс установява правилата за разработване, включително одобрение, държавна регистрация на технически регламенти, както и правилата за тяхната проверка, преразглеждане, изменение, отмяна, прилагане, официално публикуване, уведомяване за напредъка на разработването и публикуване на информация за технически регламенти.
Държавният стандарт е една от основните категории стандарти в Република Беларус.
Интегрирането на Република Беларус в световната икономика, активизирането на външноикономическата дейност, промотирането на беларуските продукти на международните пазари, както и задачите на социално-икономическото развитие на страната наложиха реформа на техническото законодателство.
През 2004 г. беше приет и влезе в сила Законът на Република Беларус „За техническо регулиране и стандартизация“, който се основава на разпоредбите на споразуменията на Световната търговска организация, отчита аспекти на системите за техническо регулиране и стандартизация на Русия , Украйна и други страни, както и Европейския съюз.
5.2 Контрол на качеството на солна киселина. Технически изисквания
Солната киселина се произвежда в две степени: А и Б. Според физико-химичните параметри техническата синтетична солна киселина трябва да отговаря на стандартите, посочени в таблица 5.1.
Таблица 5.1Норми на солна киселина
| Име на държавата | Норма за марката | Методи за анализ | ||
| AOCP 21 2211 0100 | BOKP21 2211 0200 | |||
| премия OKP 21 2211 0220 | първи клас ОКП 21 2211 0230 | |||
| 1. Външен вид | Бистра безцветна или жълтеникава течност | бистра жълта течност | Съгласно 6.4 | |
| 2. Масова част на хлороводород,%, не по-малко от | 35 | 33 | 31,5 | Съгласно 6.5 |
| 3. Масова част от желязото (Fe),%, не повече | 0,001 | 0,002 | 0,015 | Съгласно 6.6 |
| 4. Масова част на остатъка след калциниране,%, не повече | 0,010 | 0,015 | 0,100 | Съгласно 6.7 |
| 5. Масова част на свободния хлор,%, не повече | 0,002 | 0,002 | 0,008 | Съгласно 6.8 |
| 6. Масова част от арсен (As),%, не повече | 0,0001 | 0,0001 | 0,0002 | Съгласно 6.9 |
| 7. Масова част от живак (Hg), % не повече | 0,0003 | 0,0004 | 0,0005 | Към 6.10 |
Външният вид се определя визуално в пропускащата светлина на колона течност, излята в цилиндър 1.2-100 съгласно GOST 1770.
Методът за определяне се основава на реакцията на неутрализация на водородни йони с натриев хидроксид:
(5.1)
Като индикатор се използва метилоранж.
Оборудване, реактиви, разтвори:
Бюрета 1, 25 3-25-0,1 съгласно GOST 29251;
Колба Kn-1,2-100, 250-1 съгласно GOST 25336;
Колба 2-250, 1000 съгласно GOST 1770;
Пипета 2-20 съгласно GOST 29169;
Цилиндър 1.2-25 съгласно GOST 1770;
Натриев хидроксид съгласно GOST 4328, химически чист, разтвор с концентрация c(NaON) = 0,1 mol/dm3, приготвен съгласно GOST 25794.1;
Метилов оранжев (индикатор), разтвор с масова част от 0,1%; приготвя се воден разтвор съгласно GOST 4919.1;
Дестилирана вода съгласно GOST 6709 и несъдържаща въглероден диоксид се приготвя съгласно GOST 4517.
В предварително претеглена колба с шлифована запушалка с вместимост 100 cm 3 и съдържаща 20 cm 3 вода се поставят 3 cm 3 от анализираната киселина и се претеглят отново (резултатът от претеглянето се записва до четвъртия знак след десетичната запетая). Разтворът се прехвърля количествено в мерителна колба с вместимост 250 cm 3, многократно се изплаква с дестилирана вода, излива се в мерителна колба, обемът се регулира до марката с вода и се смесва. Отпипетирайте 20 cm 3 от получения разтвор на солна киселина в конична колба с вместимост 250 cm 3, добавете 25 cm 3 вода, 2-3 капки индикатор метилоранж и титруйте с разтвор на натриев хидроксид, докато червеният цвят се промени на жълто.
Масова част от хлороводорода х , %, изчислено по формулата:
Където V - обемът на разтвора на натриев хидроксид с концентрация точно c (NaOH) = 0,1 mol / dm 3, който отива за титруване, cm 3;
V 1 - обемът на разтвора на анализираната солна киселина, взет за извършване на анализа, cm 3;
м - маса на колбата с вода, g;
m 1
- маса на колбата с вода и анализирана киселина, g;
0,003646 - маса на хлороводород, съответстваща на 1 cm 3 разтвор на натриев хидроксид, концентрация точно c (NaOH) \u003d 0,1 mol / dm 3, g / cm 3.
Резултатът от анализа се приема като средноаритметично от резултатите от две паралелни измервания, допустимите несъответствия между които не трябва да надвишават 0,3% с ниво на достоверност Р = 0,95 .
Допустимите несъответствия между резултатите, получени в двете лаборатории, не трябва да надвишават 0,6%. Относителна обща грешка на определяне ±2% при ниво на достоверност Р= 0,95 .
Масовата част на желязото се определя в солна киселина след разреждане на пробата без нейната предварителна неутрализация. Неутрализацията се извършва след въвеждането на сулфосалова киселина, т.е. неутрализацията и образуването на сулфосалицилатен комплекс от желязо 3, оцветен в жълто в леко алкална среда (рН 8,0-11,5), се извършват едновременно. Интензитетът на светлопоглъщане на образувания комплекс се измерва на фотоелектричен колориметър. Диапазон на измерване 5·10 -4 - 2,0·10 -2%.
Оборудване, разтвори, реактиви:
Фотоелектрически лабораторен колориметър ФЕК-56М, КФК или друг тип, осигуряващ зададената чувствителност и точност;
Хронометър механичен всяка марка;
Чаша SZ-14/8 съгласно GOST 25336;
Колби 1.2-50, 100, 250 и 1000 cm 3 съгласно GOST 1770;
Пипети 1, 2, 5, 7-1, 25, 2, 5, 10 съгласно GOST 29169;
Солна киселина съгласно GOST 3118, химически чист, воден разтвор (1: 1);
Воден разтвор на амоняк съгласно GOST 3760, аналитичен клас, разтвор с масова част от 25%;
Сулфосалицилова киселина съгласно GOST 4478, аналитичен клас, концентрация на разтвора 100 g/dm 3 ;
Желязно-амониева стипца в съответствие с действащата нормативна документация;
Приготвя се разтвор на желязо с концентрация 1 mg / cm 3 съгласно GOST 4212, прясно приготвен разтвор с концентрация 10 μg / cm 3 се приготвя чрез разреждане;
Дестилирана вода съгласно GOST 6709.
Подготовка за анализ
Приготвяне на разтвор на сулфосалинова киселина 10 g сулфосалинова киселина се прехвърлят в мерителна колба с вместимост 100 cm 3, разтварят се, обемът се регулира до марката с вода, смесва се. Резултатите от претеглянето се записват до втория знак след десетичната запетая.
Приготвяне на калибровъчни разтвори и калибриране на фотоелектричен колориметър.
Градуирането и определянето се извършва съгласно GOST 10555 по сулфосалицилов метод.
30 cm 3 дестилирана вода се въвеждат в мерителни колби с вместимост 50 cm 3, 1 cm 3 разтвор на солна киселина, 1,0, се добавя с пипета; 2.0; 3.0; 4.0; 6,0 cm 3 разтвор на желязо с концентрация 10 μg / cm 3, 2 cm 3 разтвор на сулфосалова киселина и 5 cm 3 разтвор на амоняк. След добавяне на всеки реагент разтворът се разбърква. Обемът на разтвора се довежда до марката с вода и се смесва. В същото време се приготвя контролен разтвор: 30 cm 3 вода, 1 cm 3 солна киселина се въвеждат в мерителна колба с вместимост 50 cm 3, добавят се 2 cm 3 разтвор на сулфосалицилова киселина и след това продължете както е описано по-горе.
Оптичната плътност на калибриращите разтвори се измерва след (10 ± 1) min в кювети с дебелина на слоя на абсорбиращия светлина разтвор от 50 mm при дължина на вълната 434 nm спрямо контролния разтвор. Позволено е да се калибрира инструментът с помощта на метода на най-малките квадрати.
Въз основа на получените резултати се изгражда калибрационна графика, нанасяща масата на желязото, въведено в калибрационните разтвори в микрограмове по абсцисната ос, и съответните стойности на оптичните плътности по ординатната ос. Калибрационната крива се проверява веднъж на тримесечие, както и при смяна на реактиви или инструменти.
Анализ
Част от анализираната солна киселина с тегло (20 ± 1) g се прехвърля количествено в мерителна колба с вместимост 250 cm 3, чашата се изплаква няколко пъти с вода, обемът на разтвора се регулира с вода до марката и се смесва. . Резултатите от претеглянето се записват до втория знак след десетичната запетая.
За степени А и В от най-висок клас се вземат 25 cm 3 с пипета, а за степен B от 1-ви клас - 2,5 cm 3 от приготвения разтвор, прехвърлени в мерителна колба с вместимост 50 cm 3, добавете 2 cm 3 разтвор на сулфосалицилова киселина и се разбърква. След това добавете 10 cm 3 разтвор на амоняк, доведете обема до марката с вода и разбъркайте.
Пригответе контролния разтвор, както е описано в 6.6.3.2. След (10 ± 1) min се измерва оптичната плътност и с помощта на графиката за калибриране се намира масата на желязото в анализирания разтвор в микрограмове.
Обработка на резултатите
Масова част от желязото X 1 %, изчислено по формулата:
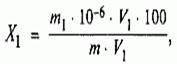
Където m 1 е масата на желязото в анализирания разтвор, намерена от калибровъчната крива, μg;
м - тегло на пробата от солна киселина, взета за извършване на анализа, g;
V - обемът на разтвора на солна киселина, получен след разреждане на масата на солна киселина, cm 3;
V 1 - обем на разредения разтвор на солна киселина, взет за анализ, cm3.
Резултатът от анализа се приема като средноаритметично от резултатите от две паралелни измервания, несъответствията между които не трябва да надвишават 0,0005%. Резултатите от определянето се закръглят до четвъртия знак след десетичната запетая.
Допустимите несъответствия между резултатите, получени в двете лаборатории, не трябва да надвишават 0,0005%. Абсолютната обща грешка на определянето е ±0,2 A, където A е резултатът от определянето при ниво на достоверност Р = 0,95 .
Определяне на масовата част на остатъка след калциниране
Масовата част на остатъка след калциниране при 600 °C се измерва чрез гравиметричен метод. Диапазонът на определяне е от 0,005% до 0,100%.
Оборудване, разтвори и реактиви:
Цилиндър 2-100 съгласно GOST 1770;
Кварцова чаша тип KP с капацитет 100 cm 3 съгласно GOST 1990S, платина или порцелан;
Ексикатор 2-190 mm, 250 mm по GOST 25336;
Муфелна пещ с термодвойка, която поддържа температура (600±10) °C;
Сярна киселина съгласно GOST 4204, хл.;
Калциев хлорид, калциниран при 250-300 °C;
Дестилирана вода съгласно GOST 6709;
Пясъчен часовник за 5 мин.
Подготовка за анализ
Чашата се калцинира в муфелна пещ при температура (600 ± 10) °C за (5 ± 1) минути. След това чашата се поставя в ексикатор с калциев хлорид и се инкубира за (30 ± 5) минути. Охладената чаша се претегля. Резултатите от претеглянето се записват до четвъртия знак след десетичната запетая.
Анализ
85 cm3 анализирана солна киселина се вземат с цилиндър и се поставят в кварцова чаша, добавя се 1 капка сярна киселина и сместа се изпарява почти до сухо на водна баня. Чашата с остатъка се нагрява на електрическа печка до спиране на отделянето на пари от сярна киселина. Изпаряването на анализираната киселина и разлагането на сярната киселина може да се извърши под инфрачервена лампа.
След това чашата с остатъка се прехвърля в муфелна пещ, предварително загрята до (600 ± 10) °C и се калцинира за (5 ± 1) min. Преместете чашата в ексикатор, оставете (30 ± 5) минути и претеглете.
Обработка на резултатите
Масова част на остатъка след калциниране X 2 %, изчислено по формулата:
Където m 1 - маса на чашата с остатъка след калциниране, g;
м - тегло на празната чаша, g;
V - обемът на взетата за анализ проба солна киселина, cm3;
стр - плътност на солна киселина, g/cm 3 .
Резултатът от анализа се приема като средноаритметично от резултатите от две паралелни измервания, допустимите несъответствия между които не трябва да надвишават 0,0006%. Резултатите от паралелните определяния се закръглят до 0,0001%, резултатът от определянето е 0,001%. Допустимите несъответствия между резултатите, получени в двете лаборатории, не трябва да надвишават 0,0008%. Абсолютна обща грешка на определяне ± 0,0005% при ниво на достоверност Р = 0,95 .
5.2.6 Определяне на масовата част на свободния хлор
Методът се основава на реакцията на окисляване на метилоранж с хлор:
 |
(6.5)
В резултат на окисляването на метилоранж цветът на неговите разтвори става по-малко интензивен. Интензитетът на цвета зависи от реда на смесване на разтворите, така че анализираната солна киселина се добавя последна при разбъркване. Методът е селективен, желязото (III) пречи на определянето. Диапазон на измерване 5·10 -4 - 8·10 -3%.
Оборудване, реактиви и разтвори:
Фотоелектрически лабораторен колориметър КФК или друг тип, осигуряващ зададената чувствителност и точност;
Мерителни колби 2-25, 1000 съгласно GOST 1770;
Пипети 1,5-1,2 съгласно GOST 29169;
Солна киселина съгласно GOST 3118, химически чиста, разтвор (1: 2);
Метилов оранжев (индикатор), разтвор с концентрация 0,1 g / dm 3, се приготвя, както следва: 0,1 g метилов оранжев се прехвърля в мерителна колба с вместимост 1000 cm 3, обемът на разтвора се регулира до марката с вода и се смесва. Резултатите от претеглянето се записват до втория знак след десетичната запетая.
Приготвяне на калибровъчни разтвори и калибриране на фотоелектроколориметър
15 cm 3 вода се въвеждат в мерителни колби с вместимост 25 cm 3, 2,0 се добавя с пипета; 1.6; 1.2; 0,8; 0,4 cm 3 разтвор на метилоранж, което съответства на 0; 10; 20; тридесет; 40 μg хлор, добавете 1 cm 3 разтвор на солна киселина, разредете обема на разтвора с вода до марката и разбъркайте.
Оптичната плътност на получените разтвори се измерва на фотоелектроколориметър при дебелина на слоя поглъщащ светлина разтвор 10 mm и дължина на вълната 490-505 nm. Еталонен разтвор - дестилирана вода.
Въз основа на получените данни се изгражда калибровъчна графика, като по абсцисната ос се нанася масата на хлора в микрограмове, а по ординатната ос - съответната стойност на оптичните плътности.
Калибрационната крива се проверява веднъж на тримесечие, както и при смяна на реактиви или инструменти.
Позволено е да се калибрира инструментът с помощта на метода на най-малките квадрати.
Анализ
15 cm 3 дестилирана вода се поставят в мерителна колба с вместимост 25 cm 3, като се разбъркват енергично, 2 cm 3 разтвор на метилоранж, (0,5-2) cm 3 от анализираната солна киселина се инжектират с пипета , обемът на разтвора се довежда до марката с вода и се разбърква. Оптичната плътност на получения разтвор се измерва на фотоелектричен колориметър при дебелина на слоя абсорбиращ светлина от разтвора 10 mm и дължина на вълната 490-505 nm. Еталонен разтвор - дестилирана вода.
Масата на хлора в микрограмове в киселина се намира съгласно кривата на калибриране.
Обработка на резултатите
Масова част на свободния хлор X 3 , %, изчислено по формулата:
Където м - масата на хлора в анализираната солна киселина, намерена от калибровъчната графика, mkt;
V - обемът на солната киселина, взет за извършване на анализа, cm 3;
стр - плътност на анализираната солна киселина, g/cm 3 .
Резултатът от анализа се приема като средноаритметично от резултатите от три паралелни измервания, несъответствията между които не трябва да надвишават 0,0003%, Резултатите от определянето се закръглят до 0,0001%.
Допустимите несъответствия между резултатите, получени в двете лаборатории, не трябва да надвишават 0,0005%.
Абсолютната обща грешка на определянето е в диапазона от ±0,2 A, където A е резултатът от определянето при ниво на достоверност Р = 0,95
.
5.3 Транспорт и съхранение
Теглото на пакета не трябва да надвишава товароносимостта на палета.
В железопътен вагон пакетите са монтирани така, че капацитетът (товароносимост) на вагона да се използва напълно.
Техническата синтетична солна киселина се съхранява в запечатани контейнери на производителя и потребителя, изработени от материали, устойчиви на солна киселина.
Срокът на годност на продукта е неограничен.
Заключение
В края на курсовата работа могат да се направят някои изводи.
Солната киселина е бистра, безцветна или жълтеникава течност без суспендирани или емулгирани частици.
Солната киселина се използва в химическата, медицинската, хранително-вкусовата промишленост, цветната и черната металургия.
Солната киселина (солна киселина), чийто химичен състав съответства на хлороводорода, се използва широко в редица сектори на националната икономика.
В промишлеността солната киселина се произвежда по следните начини:
сулфат;
Синтетичен
От отпадъчни газове (странични газове) на редица процеси.
Техническата синтетична солна киселина трябва да се произвежда в съответствие с изискванията на стандартите съгласно технологичните правила, одобрени по предписания начин.
Техническа синтетична солна киселина в съответствие с правилата за превоз на опасни товари се транспортира:
В насипно състояние в железопътни цистерни ("Правила за превоз на опасни товари № 340", част 2, раздел 41);
Опаковани в бъчви и бутилки в кутии - железопътен транспорт в покрити вагони с вагонни пратки ("Правила за превоз на опасни товари № 340", част 2, раздел 42);
Опаковани в контейнери, бъчви, бутилки - автомобилен и воден транспорт.
Бъчвите и бутилките, когато се доставят в опаковки, се оформят върху плоски дървени палети в съответствие с GOST 9557-87 в съответствие с изискванията на GOST 21650, GOST 24597 и GOST 26663.
списъкИЗПОЛЗВАНИ ИЗТОЧНИЦИ
1. Асатурян Н.Г., Гол В.Н. Справочник на търговеца на нехранителни стоки , М.: Икономика, 1990. - 349 с.
2. Брозовски D.I. Мърчандайзинг на нехранителни стоки. М.: UNITI, 1990. - 398 с.
3. Демидова Г.А. и др., "Стокознание на нехранителни стоки", Т. 4, М. 1987 г.
4. Демидова Г.А. Мърчандайзинг на нехранителни стоки. М.: Луч, 2000.- 487 с
5. Епифанцева В.В. Химическата промишленост на Беларус, Минск: Висше училище, 2005. - 274 с.
6. Каролкова Р.В. Химическа промишленост, - Санкт Петербург: Питър, 2005. - 285с.
7. Лифиц И.М. Основи на стандартизацията, метрологията, сертификацията: Учебник. – М.: Юрайт, 1999. – 252 с.
8. Постановление на Комитета по стандартизация, метрология и сертификация към Министерския съвет на Република Беларус № 35 от 30.06.2004 г.
9. Сицко В.Е., Дрозд М.И. Изследване на стоките на нехранителни стоки Минск: Висше училище, 2005. - 663 с.
10. Икономически вестник - бр.12 - 2005г
Азотна киселина- едноосновна киселина, която има формата на течност с жълтеникав оттенък. Използва се главно като реагент, но има много области, в които киселината също намира приложение. Веществото има остра неприятна миризма. Азотната киселина принадлежи към вещества от 3-ти клас на опасност. Следователно съхранението и употребата на реагента трябва да се вземат сериозно. Азотната киселина има способността да окислява повечето метали. Работата с киселина изисква специално облекло: гащеризони, обувки, ръкавици, респиратор, очила. Когато работите с киселина, трябва да бъдете много внимателни, тъй като контактът на веществото с кожата може да доведе до неприятни усещанияи дори алергии.
Използването на азотна киселина в промишлеността
Поради свойствата си областите на приложение на азотната киселина са много разнообразни:
- Химическата промишленост често прибягва до помощта на азотна киселина. Изкуствените влакна се синтезират поради участието в процеса на азотна киселина.
- Ракетната и космическа индустрия използва киселина за създаване на ракетно гориво.
- Бижутата се проверяват за автентичност с азотна киселина. С помощта на това химическиопределя се проба злато.
- В металургичната промишленост се използва и азотна киселина, чието използване гарантира разтварянето и ецването на почти всички известни метали.
Много процеси, известни на вас, включват азотна киселина, чието използване в промишлеността е от особено значение.
Използването на азотна киселина в ежедневието
Възможно е почистване на бижута у дома. За това се използва азотна киселина. Домашната употреба трябва да бъде изключително внимателна, за да се предотврати възможността за киселинно взаимодействие с кожата. Ако се случи, че киселината все още попадне върху кожата, струва си да изплакнете засегнатата област с чешмяна вода. След това можете да неутрализирате киселината с амоняк. Азотната киселина при капково напояване действа като почистващо средство. За да разтворите утайката или да се отървете от натрупването на соли в капковата система, е необходимо да използвате 60% азотна киселина.
Използването на азотна киселина в медицината
Някои лекарства съдържат азотна киселина. Използването на химикал в медицината помага в борбата със заболяванията на кожата и стомашно-чревния тракт. И така, 30% азотна киселина се използва за борба с получените брадавици. Концентрацията на киселина е от особено значение, когато говорим сиза човешкото здраве. За лечение на пептична язва азотната киселина се използва под формата на бисмутови соли. Това лекарство има стягащи и антисептични свойства.
Използването на азотна киселина в селското стопанство
За да бъде реколтата богата, много агрономи използват минерални торове. Някои от тях съдържат азотна киселина. Приложението в селското стопанство е възможно под формата на тор или селитра. Така че зеленчуците и плодовете, които са били изложени на тор, не увреждат здравето на човека, който ги консумира, е необходимо ясно да се изчисли дозата на тора. Излишъкът от последния може да доведе до повишено натрупване на нитрати в крайния продукт. Има три вида азотни торове: амонячни, нитратни и амидни. Торовете са склонни да се измиват върху песъчливи почви.
В допълнение към азотната киселина в нейната чиста форма, нейните производни са намерили приложение - соли на азотна киселина, чиято употреба е по-търсена от техния източник. Някои видове нитроестери се използват във фармацевтични препарати за лечение на ангина пекторис. Нитроглицерин се приема от хора, страдащи от коронарна недостатъчност.
Приготвянето и използването на азотна киселина изисква специално внимание. Затова трябва да се съхранява в помещения, където има вентилационна система. За да избегнете неприятни ситуации, контейнерът с азотна киселина трябва да се държи далеч от нагряващи предмети. Контактът със слънчева светлина също е нежелателен. Киселината трябва да се транспортира в херметически затворени стоманени контейнери. За съхранение се използват алуминиеви съдове.
Можете да закупите азотна киселина в необходимото количество в нашия специализиран магазин. Кликнете върху връзката, за да видите продукта